NORMA OFICIAL MEXICANA NOM-114-SSA1-1994, BIENES Y SERVICIOS. MÉTODO PARA LA DETERMINACIÓN DE SALMONELLA EN ALIMENTOS.
Al margen un sello con el Escudo Nacional, que dice: Estados Unidos Mexicanos.- Secretaría de Salud.
JOSE MELJEM MOCTEZUMA, Director General de Control Sanitario de Bienes y Servicios, por acuerdo del Comité Consultivo Nacional de Normalización de Regulación y Fomento Sanitario, con fundamento en los artículos 39 de la Ley Orgánica de la Administración Pública Federal; 38, fracción II, 47 de la Ley Federal sobre Metrología y Normalización; 194 fracción I de la Ley General de Salud; 2o. fracción III, 34, 37, 40 y demás aplicables del Reglamento de la Ley General de Salud en Materia de Control Sanitario de Actividades, Establecimientos, Productos y Servicios; 8o. fracción IV y 13 fracción I del Reglamento Interior de la Secretaría de Salud.
PREFACIO
En la elaboración de la presente norma participaron los siguientes organismos e instituciones:
SECRETARIA DE SALUD
Laboratorio Nacional de Salud Pública
Dirección General de Control
Sanitario de Bienes y Servicios
SECRETARIA DE MEDIO AMBIENTE, RECURSOS NATURALES Y PESCA
Instituto Nacional de Pesca
SECRETARIA DE AGRICULTURA, GANADERIA Y DESARROLLO RURAL
Comisión Nacional del Agua
INSTITUTO POLITECNICO NACIONAL
Escuela Nacional de Ciencias Biológicas
INDUSTRIAS VINICOLAS PEDRO DOMECQ
JUGOS DEL VALLE, S.A. DE C.V.
LABORATORIO FERMI, S.A.
LABORATORIO ICCABI, S.A. DE C.V.
LECHE INDUSTRIALIZADA CONASUPO, S.A. DE C.V. LICONSA
SIGMA ALIMENTOS, S.A. DE C.V.
SOCIEDAD MEXICANA DE NORMALIZACION Y CERTIFICACION, S.C.
NORMEX
INDICE
0. INTRODUCCION
1. OBJETIVO Y CAMPO DE APLICACION
2.
FUNDAMENTO
3. REFERENCIAS
4. DEFINICIONES
5. SIMBOLOS Y
ABREVIATURAS
6. REACTIVOS Y MATERIALES
7. EQUIPO
8. PROCEDIMIENTO
9.
CALCULO Y EXPRESION DE RESULTADOS
10. CONCORDANCIA CON NORMAS
INTERNACIONALES
11. BIBLIOGRAFIA
12. OBSERVANCIA DE LA NORMA
13.
VIGENCIA
14. APENDICE INFORMATIVO
APENDICE A
0. Introducción
Los miembros del género Salmonella han sido muy estudiados como patógenos cuando se encuentran presentes en los alimentos. El control de este microorganismo, tanto por parte de las autoridades sanitarias, como en las plantas procesadoras de alimentos, depende en cierta medida del método analítico utilizado para su detección.
Este microorganismo fue inicialmente identificado en muestras clínicas y los métodos empleados para estos casos se adaptaron posteriormente para su detección en alimentos. Las modificaciones a los métodos consideraron dos aspectos principales, el primero es el debilitamiento o daño a las células bacterianas presentes en un alimento, debido al proceso a que está sujeto (por ejemplo: tratamiento térmico, secado, etc.) y segundo, la variabilidad inherente a la naturaleza del producto bajo estudio.
Para diversos alimentos existen diferentes protocolos para el aislamiento de Salmonella, todos ellos son esencialmente similares en principio y emplean las etapas de preenriquecimiento, enriquecimiento selectivo, aislamiento en medios de cultivo selectivos y diferenciales, identificación bioquímica y confirmación serológica de los microorganismos.
1. Objetivo y campo de aplicación
1.1 Esta Norma Oficial Mexicana establece un método general para la determinación de Salmonella en alimentos.
1.2 Esta Norma Oficial Mexicana es de observancia obligatoria en el territorio nacional para las personas físicas y morales que requieran efectuar este método en productos nacionales y de importación para fines oficiales.
2. Fundamento
La presente técnica para la detección de Salmonella en alimentos, describe un esquema general que consiste de 5 pasos básicos:
2.1 Preenriquecimiento, es el paso donde la muestra es enriquecida en un medio nutritivo no selectivo, que permite restaurar las células de Salmonella dañadas a una condición fisiológica estable.
2.2 Enriquecimiento selectivo, empleado con el propósito de incrementar las poblaciones de Salmonella e inhibir otros organismos presentes en la muestra.
2.3 Selección en medios sólidos, en este paso se utilizan medios selectivos que restringen el crecimiento de otros géneros diferentes a Salmonella y permite el reconocimiento visual de colonias sospechosas.
2.4 Identificación bioquímica, este paso permite la identificación génerica de los cultivos de Salmonella y la eliminación de cultivos sospechosos falsos.
2.5 Serotipificación, es una técnica serológica que permite la identificación específica de un cultivo.
3. Referencias
Esta norma se complementa con la siguiente Norma Oficial Mexicana:
NOM-109-SSA1-1994 Procedimiento para la toma, manejo y transporte de muestras de alimentos para su análisis microbiológico.*
4. Definiciones
Para fines de esta norma se entiende por:
4.1 Detección de Salmonella: determinación de la presencia o ausencia de estos microorganismos en una masa determinada de producto, cuando las pruebas se llevan a cabo de acuerdo con esta norma.
4.2 Salmonella: microorganismo patógeno perteneciente al grupo de Enterobacterias. Bacilo gram negativo, aerobio, no esporulado que forman colonias típicas en medios selectivos sólidos y que presentan además las características bioquímicas y serológicas descritas cuando los procedimientos se efectúan de acuerdo con esta norma.
5. Símbolos y abreviaturas
Cuando en esta norma se haga referencia a las siguientes abreviaturas, se entiende por:
g gramos
ºC grados celsius
l litros
ml mililitros
cm centímetros
mm milímetros
min minutos
h hora
± más, menos
p. ejem. por ejemplo
N Normal
µm micrómetro
lb libras
cbp cuanto basta para
% por ciento
x por
pH potencial de hidrógeno
6. Reactivos y materiales
En caso de disponerse de fórmulas comerciales deshidratadas, se deben seguir las instrucciones impresas en la etiqueta respectiva para su preparación.
Las sustancias químicas usadas para preparar los medios de cultivo y los reactivos deben ser grado analítico.
6.1 Reactivos
6.1.1 Medios de pre-enriquecimiento
6.1.1.1 Agua de peptona tamponada
Fórmula
Ingredientes Cantidades Unidades
Peptona 10,0 g
Cloruro sódico 5,0 g
Fosfato sódico dibásico 3,5 g
Fosfato potásico monobásico 1,5 g
Agua 1,0 l
Preparación
Disolver los componentes en agua, calentando si es necesario.
Ajustar el pH, si es necesario, después de la esterilización a 7,0.
Distribuir en recipientes de vidrio esterilizables con la capacidad necesaria para obtener las porciones necesarias para la prueba.
Esterilizar por 20 min a 121 ± 1ºC.
6.1.1.2 Caldo lactosado
Fórmula
Ingredientes Cantidades Unidades
Extracto de carne 3,0 g
Peptona 5,0 g
Lactosa 5,0 g
Agua destilada 1,0 l
pH final: 6,9 ± 0,2
Preparación
Disolver los ingredientes en agua, calentando a 65ºC.
Distribuir en porciones de 225 ml, en frascos de 500 ml.
Esterilizar durante 15 min a 121ºC ± 1ºC.
6.1.2 Caldo de enriquecimiento
6.1.2.1 Caldo selenito-cistina
Fórmula
Ingredientes Cantidades Unidades
Triptona o polipeptona 5,00 g
Lactosa 4,00 g
Fosfato disódico 10,00 g
Selenito ácido de sodio 4,00 g
L-cistina 0,01 g
Agua destilada 1,00 l
pH final: 7,0 ± 0,2 a 25ºC
Preparación
Disolver los ingredientes en un litro de agua destilada estéril y distribuir en volúmenes de 10 y 225 ml en recipientes estériles, según se requiera.
El caldo así preparado es transparente. De preferencia usarlo el mismo día de su preparación.
Si se desea conservar el medio por varios días, puede exponerse al calor en autoclave por 5 min a 110ºC ± 1ºC, tomando entonces un color salmón.
6.1.2.2 Caldo tetrationato
Fórmula
Ingredientes Cantidades Unidades
Proteosa peptona o triptona 5,0 g
Sales biliares 1,0 g
Carbonato de calcio 10,0 g
Tiosulfato de sodio pentahidratado 30,0 g
Agua destilada 1,0 l
pH final: 7,0 ± 0,1
Preparación
Disolver los ingredientes en un litro de agua destilada estéril.
Distribuir, agitando constantemente, en porciones de 10 y 225 ml, en recipientes estériles. Guardar en refrigeración.
Antes de usar el medio, agregar 2 ml de una solución yodo-yoduro y 1 ml de solución de verde brillante al 0,1% por cada 100 ml de caldo. El medio una vez adicionado de yodo no debe calentarse y debe usarse el mismo día de su preparación.
6.1.2.3 Vassiliadis-Rappaport
Fórmula
Solución A
Ingredientes Cantidades Unidades
Triptona 5,0 g
Cloruro de sodio 8,0 g
Fosfato de potasio dihidrogenado 1,6 g
Agua destilada 1,0 l
Disolver los componentes en agua por calentamiento cercano a 70ºC.
Solución B
Ingredientes Cantidades Unidades
Cloruro de magnesio hexahidratado 400,0 g
Agua destilada 1,0 l
Disolver el cloruro de magnesio en agua.
Como esta sal es muy higroscópica es conveniente disolver el contenido entero de cloruro de magnesio desde un recipiente recientemente abierto de tal modo que la concentración de la solución sea de 0,4 g/ml.
Conservar en frasco ámbar a temperatura ambiente.
Solución C
Ingredientes Cantidades Unidades
Oxalato de verde de malaquita 0,4 g
Agua destilada 100,0 ml
Disolver el oxalato de verde de malaquita en agua.
Conservar en frasco ámbar a temperatura ambiente.
Medio completo
Ingredientes Cantidades Unidades
solución A 1000 ml
solución B 100 ml
solución C 10 ml
Preparación
Adicionar 1 000 ml de la solución A, 100 ml de la solución B y 10 ml de la solución C.
Ajustar el pH si es necesario, de tal manera que después de la esterilización sea de 5,2.
Distribuir antes de usar dentro de tubos en cantidades de 10 ml.
Almacenar en refrigeración.
6.1.2.4 Caldo de soya tripticasa
Fórmula
Ingredientes Cantidades Unidades
Tripticasa o triptosa 17,0 g
Fitona 3,0 g
Glucosa 2,5 g
Cloruro de sodio 2,5 g
Agua destilada 1,0 l
pH final: 7,3 ± 0,2
Preparación
Disolver los ingredientes en 1 litro de agua destilada, calentando lentamente hasta su disolución completa.
Distribuir porciones de 225 ml dentro de matraces de 500 ml y esterilizar en autoclave durante 15 min a 121ºC ± 1ºC.
6.1.2.5 Leche descremada reconstituida
Suspender 100 g de leche descremada en polvo en un litro de agua destilada. Agitar circularmente hasta disolución. Distribuir en volúmenes de 225 ml en matraces Erlenmeyer de 500 ml. Esterilizar a 121ºC ± 1ºC por 15 min. El volumen final debe corregirse para mantener 225 ml.
6.1.2.6 Caldo soya tripticasa estéril adicionado con sulfito de potasio
Adicionar al caldo soya tripticasa 5 g de sulfito de potasio por cada 1000 ml de medio, quedando una concentración final de sulfito de potasio del 0,5%. Adicionar el sulfito de potasio antes de esterilizar en autoclave en la forma habitual.
6.1.3 Medios de aislamiento
6.1.3.1 Agar verde brillante (VB)
Fórmula
Ingredientes Cantidades Unidades
Extracto de levadura 3,0000 g
Polipeptona (Proteosa peptona No. 3) 10,0000 g
Cloruro de sodio 5,0000 g
Lactosa 10,0000 g
Sacarosa 10,0000 g
Rojo de fenol 0,0800 g
Agar 20,0000 g
Verde brillante 0,0125 g
Agua destilada 1,0000 l
pH final: 6,9 ± 0,2
Preparación
Suspender los ingredientes en un litro de agua destilada y calentar a ebullición, hasta disolución completa. Ajustar el pH.
Esterilizar en autoclave por 15 min a 121ºC ± 1ºC. El sobrecalentamiento del medio disminuye su selectividad.
Enfriar el medio a 50ºC y distribuirlo en cajas de petri estériles. El aspecto del medio es obscuro, de color marrón.
6.1.3.2 Agar con sulfito de bismuto
Fórmula
Ingredientes Cantidades Unidades
Extracto de carne de res 5,000 g
Mezcla de peptonas 10,000 g
Glucosa 5,000 g
Fosfato disódico (anhidro) 5,000 g
Sulfato ferroso (anhidro) 0,300 g
Sulfito de bismuto 8,000 g
Verde brillante 0,025 g
Agar 20,000 g
Agua destilada 1,000 l
pH final: 7,6 ± 0,2
Preparación
Suspender los ingredientes en un litro de agua. Calentar hasta su disolución completa, agitando frecuentemente. Ajustar el pH.
Enfriar a 45ºC y verter en cajas de petri estériles, distribuyendo de manera homogénea el precipitado propio del medio.
El aspecto de las placas es opaco, de color verde pálido y deben usarse el mismo día de su preparación. Si la coloración es parda, no deben utilizarse.
El medio no debe esterilizarse en autoclave; el sobrecalentamiento afecta su selectividad.
6.1.3.3 Agar xilosa lisina desoxicolato (XLD)
Fórmula
Ingredientes Cantidades Unidades
Xilosa 3,75 g
L-lisina 5,00 g
Lactosa 7,50 g
Sacarosa 7,50 g
Cloruro de sodio 5,00 g
Extracto de levadura 3,00 g
Rojo de fenol 0,08 g
Agar 15,00 g
Desoxicolato de sodio 2,50 g
Citrato férrico-amónico 0,80 g
Tiosulfato de sodio 6,80 g
Agua destilada 1,00 l
pH final: 6,9 ± 0,2
Preparación
Suspender los ingredientes en un litro de agua destilada, y calentar en baño de agua a 55ºC, agitando frecuentemente, hasta disolución completa. Ajustar el pH.
Enfriar a 50ºC y verter en cajas de petri estériles. No se esterilice.
El sobrecalentamiento produce una precipitación; la reactividad del medio puede ser satisfactoria, pero las colonias suelen ser muy pequeñas.
El aspecto del medio es claro y de color rojo brillante.
6.1.3.4 Agar para Salmonella y Shigella (SS)
Fórmula
Ingredientes Cantidades Unidades
Extracto de carne 5,000 g
Polipeptona * 5,000 g
Lactosa 10,000 g
Sales biliares 8,500 g
Citrato de sodio dihidratado 8,500 g
Tiosulfato de sodio pentahidratado 8,500 g
Citrato férrico 1,000 g
Agar 13,500 g
Rojo neutro 0,025 g
Verde brillante 0,330 mg
Agua destilada 1,000 l
pH final: 7,0 ± 0,2
Preparación
Suspender los ingredientes en un litro de agua destilada estéril y calentar a ebullición hasta disolución completa. Ajustar el pH. No esterilizar en autoclave.
Enfriar a 50ºC y distribuir en cajas de petri estériles en condiciones asépticas.
El aspecto del medio fundido es claro y de color rosado.
6.1.3.5 Agar entérico Hektoen
Fórmula
Ingredientes Cantidades Unidades
Proteosa peptona 12,000 g
Extracto de levadura 3,000 g
Lactosa 12,000 g
Sacarosa 12,000 g
Salicina 2,000 g
Sales biliares 9,000 g
Cloruro de sodio 5,000 g
Tiosulfato de sodio 5,000 g
Citrato amónico férrico 1,500 g
Azul de bromotimol 0,064 g
Fuscina ácida 0,100 g
Agar 13,500 g
Agua 1,000 l
pH final: 7,5 ± 0,2
Preparación
Suspender los ingredientes en agua destilada, hervir con agitación hasta completa disolución del agar. No sobrecalentar.
Dejar enfriar a 55-60ºC y distribuir en cajas de petri estériles en condiciones asépticas.
6.1.4 Medios para pruebas bioquímicas
6.1.4.1 Agar de tres azúcares y hierro (TSI)
Fórmula
Ingredientes Cantidades Unidades
Peptona de carne * 1,0 g
Peptona de caseína * 1,0 g
Cloruro de sodio 0,5 g
Lactosa 1,0 g
Sacarosa 1,0 g
Glucosa 0,1 g
Agar 1,3 g
Rojo de fenol 2,5 mg
Sulfato ferroso amónico
pentahidratado 20,0 mg
Tiosulfato de sodio 20,0 mg
Agua destilada 100,0 ml
pH final: 7,3 ± 0,2
Preparación
Suspender los ingredientes en 100 ml de agua destilada. Calentar a ebullición, agitando ocasionalmente, hasta disolución completa.
Enfriar a 60ºC y ajustar el pH.
Distribuir en volúmenes de 3 ml en tubos de 13 x 100 mm y esterilizar a 121ºC ± 1ºC durante 15 min. Inclinar los tubos de manera que el medio de cultivo en el fondo alcance una altura de 3 cm y una profundidad de 4 cm. El medio es de color rojo.
6.1.4.2 Agar de hierro y lisina (LIA)
Fórmula
Ingredientes Cantidades Unidades
Peptona de gelatina 0,5 g
Extracto de levadura 0,3 g
Glucosa 0,1 g
L-lisina 1,0 g
Citrato férrico-amónico 50,0 mg
Tiosulfato de sodio anhidro 4,0 mg
Púrpura de bromocresol 2,0 mg
Agar 1,5 g
Agua destilada 100,0 ml
pH final: 6,7 ± 0,2
Preparación
Suspender los ingredientes en el agua destilada y mezclar bien, calentar hasta ebullición con agitación frecuente hasta conseguir la disolución completa. Ajustar el pH.
Distribuir en volúmenes de 3 ml en tubos de 13 x 100 mm, con tapón de rosca.
Esterilizar en autoclave a 121ºC ± 1ºC durante 12 min. Dejar que los tubos se enfríen en posición inclinada, de tal modo que se obtengan columnas de medio de 4 cm y una superficie inclinada de 2 cm.
El medio ya preparado es de color púrpura.
6.1.4.3 Agar nutritivo
Fórmula
Ingredientes Cantidades Unidades
Extracto de carne 3,0 g
Peptona 5,0 g
Agar 15,0 g
Agua destilada 1,0 l
pH final: 6,8 ± 0,2
Preparación
Suspender los ingredientes en agua. Dejar reposar de 5 a 10 min.
Calentar a ebullición hasta disolución completa. Distribuir en tubos de 13 x 100 mm, en cantidades de 1/3 de su volumen.
Esterilizar a 121ºC ± 1ºC por 15 min. Inclinar los tubos antes que el agar solidifique.
6.1.4.4 Medio de SIM (para Sulfuro, Indol y Movilidad)
Fórmula
Ingredientes Cantidades Unidades
Extracto de carne 3,000 g
Peptona 30,000 g
Hierro peptonizado 0,200 g
Tiosulfato de sodio 0,025 g
Agua destilada 1,000 l
pH final: 7,3 ± 0,2
Preparación
Suspender los ingredientes en el agua destilada, calentar a ebullición agitando frecuentemente hasta lograr una disolución completa.
Enfriar a 50ºC y ajustar el pH.
Distribuir el medio en volúmenes de 3 ml en tubos de 13 x 100 mm y esterilizar en autoclave a 121ºC ± 1ºC durante 15 min. Se dejan enfriar los tubos en posición vertical.
6.1.4.5 Agar citrato de Simmons
Fórmula
Ingredientes Cantidades Unidades
Fosfato de amonio 1,00 g
Fosfato dipotásico 1,00 g
Cloruro de sodio 5,00 g
Citrato de sodio 2,00 g
Sulfato de magnesio 0,20 g
Azul de bromotimol 0,08 g
Agar 15,00 g
Agua destilada 1,00 l
pH final: 6,8 ± 0,2
Preparación
Suspender los ingredientes en el agua destilada, calentar a ebullición agitando frecuentemente hasta lograr una disolución completa.
Ajustar el pH.
Distribuir el medio en volúmenes de 3 ml en tubos de 13 x 100 mm y esterilizar en autoclave a 121ºC ± 1ºC durante 15 min.
Dejar enfriar los tubos en posición inclinada.
6.1.4.6 Caldo MR-VP (Rojo de metilo-Voges Proskauer)
Fórmula
Ingredientes Cantidades Unidades
Peptona 7,0 g
Dextrosa 5,0 g
Difosfato de potasio 5,0 g
Agua destilada 1,0 l
pH final: 6,9 ± 0,2
Preparación
Suspender los ingredientes en el agua destilada, calentar a ebullición agitando frecuentemente hasta lograr una disolución completa.
Ajustar el pH.
Distribuir el medio en volúmenes de 3 ml en tubos de 13 x 100 mm y esterilizar en autoclave a 121ºC ± 1ºC durante 15 min.
6.1.4.7 Caldo manitol
Fórmula
Ingredientes Cantidades Unidades
Extracto de carne 1,000 g
Proteosa peptona 10,000 g
Cloruro de sodio 5,000 g
Rojo de fenol 0,018 g
Manitol 10,000 g
Agua 1,000 l
pH final: 7,4 ± 0,2
Preparación
Suspender 26 g del medio deshidratado en un litro de agua, mezclar y ajustar el pH.
Distribuir en volúmenes de 2 a 3 ml en tubos de 13 x 100 mm.
Esterilizar a 121ºC ± 1ºC durante 15 min.
6.1.4.8 Caldo malonato
Fórmula
Ingredientes Cantidades Unidades
Extracto de levadura 1,000 g
Sulfato de amonio 2,000 g
Fosfato dipotásico 0,600 g
Fosfato monopotásico 0,400 g
Cloruro de sodio 2,000 g
Malonato 3,000 g
Glucosa 0,250 g
Azul de bromotimol 0,025 g
Agua 1,000 l
pH final: 6,7 ± 0,2
Preparación
Suspender los ingredientes en agua, mezclar y ajustar el pH.
Distribuir en tubos de 13 x 100 mm en cantidades de 3 ml.
Esterilizar en autoclave a 121ºC ± 1ºC durante 15 min.
6.1.4.9 Caldo urea
Fórmula
Ingredientes Cantidades Unidades
Urea 20,00 g
Extracto de levadura 0,10 g
Fosfato monopotásico 9,10 g
Fosfato disódico 9,50 g
Rojo de fenol 0,01 g
Agua 1,00 l
pH final: 6,8 ± 0,2
Preparación
Disolver los ingredientes en agua destilada.
NO CALENTAR. Esterilizar por filtración a través de membrana 0,45 µm o en autoclave de 5 a 8 lb de presión durante 15 min.
Distribuir asépticamente de 1,5 a 3 ml en tubos estériles de 13 x 100 mm.
6.1.4.10 Caldo de urea rápido
Fórmula
Ingredientes Cantidades Unidades
Urea 20,000 g
Extracto de levadura 0,100 g
Fosfato monopotásico 0,091 g
Fosfato disódico 0,095 g
Rojo de fenol 0,010 g
Agua 1,000 l
pH final: 6,8 ± 0,2
Preparación
Disolver los ingredientes en agua destilada.
NO CALENTAR. Esterilizar por filtración a través de membrana 0,45 µm.
Distribuir asépticamente de 1,5 a 3 ml en tubos estériles de 13 x 100 mm.
6.1.4.11 Caldo infusión cerebro corazón
Fórmula
Ingredientes Cantidades Unidades
Infusión cerebro corazón 200,0 g
Infusión de corazón de res 250,0 g
Proteosa peptona 10,0 g
Cloruro de sodio 5,0 g
Fosfato disódico dodecahidratado 2,5 g
Dextrosa 2,0 g
Agua destilada 1,0 l
pH final: 7,4 ± 0,2
Preparación
Disolver los ingredientes en agua destilada, calentar suavemente.
Distribuir y esterilizar a 121ºC ± 1ºC durante 15 min.
6.1.5 Soluciones
6.1.5.1 Solución verde brillante al 0,1% (1:1000)
Fórmula
Ingredientes Cantidades Unidades
Verde brillante 0,1 g
Agua destilada estéril 100,0 ml
Disolver 0,1 g de verde brillante en agua destilada estéril hasta completar 100 ml.
6.1.5.2 Solución de yodo-yoduro
Fórmula
Ingredientes Cantidades Unidades
Cristales de yodo 6,0 g
Yoduro de potasio 6,0 g
Agua destilada 100,0 ml
Disolver los cristales y el yoduro de potasio en agua destilada hasta completar 100 ml.
Conservar en frasco ámbar.
6.1.5.3 Solución salina al 0,85%
Fórmula
Ingredientes Cantidades Unidades
Cloruro de sodio 0,85 g
Agua destilada 100,00 ml
Disolver el cloruro de sodio en el agua y esterilizar a 121°C ± 1°C durante 15 min.
6.1.5.4 Solución salina formalizada
Fórmula
Ingredientes Cantidades Unidades
Solución de formaldehído (36-38%) 6,0 ml
Cloruro de sodio 8,5 g
Agua destilada 1,0 l
Disolver 8,5 g de cloruro de sodio en 1 litro de agua destilada. Esterilizar a 121ºC ± 1ºC durante 15 min.
Enfriar a temperatura ambiente. Adicionar 6 ml de la solución de formaldehído. No esterilizar después de la adición de formaldehído.
6.1.5.5 Reactivo de Kovac
Fórmula
Ingredientes Cantidades Unidades
p-dimetil-aminobenzaldehído 5,0 g
Alcohol amílico 75,0 ml
Acido clorhídrico concentrado 25,0 ml
Disolver el p-dimetil-aminobenzaldehído en el alcohol amílico y después agregar el ácido clorhídrico lentamente. Conservar en frasco ámbar en refrigeración.
6.1.5.6 Solución de alfa-naftol al 5%
Fórmula
Ingredientes Cantidades Unidades
Alfa-naftol 5,0 g
Alcohol 100,0 ml
Disolver 5 g de alfa-naftol en alcohol hasta completar 100 ml.
6.1.5.7 Solución de rojo de metilo
Fórmula
Ingredientes Cantidades Unidades
Rojo de metilo 0,10 g
Alcohol etílico 300,00 ml
Agua destilada c.b.p. 500,00 ml
Disolver el rojo de metilo en el alcohol etílico y adicionar agua hasta completar 500 ml.
6.1.5.8 Solución de hidróxido de potasio al 40%
Fórmula
Ingredientes Cantidades Unidades
Hidróxido de potasio 40,0 g
Agua destilada 100,0 ml
Disolver 40 g de hidróxido de potasio en agua hasta completar 100 ml.
6.1.5.9 Solución de gelatinasa al 5%
Fórmula
Ingredientes Cantidades Unidades
Gelatinasa 5,0 g
Agua 100,0 ml
Disolver 5 g de gelatinasa en 100 ml de agua destilada. NO CALENTAR.
6.1.6 Antisueros
Antisuero polivalente somático (O)
Antisuero polivalente flagelar (H)
Antisuero Vi
6.2 Material
Matraces Erlenmeyer de 500 ml
Recipientes de boca ancha, de capacidad apropiada para contener las muestras simples y compuestas
Angulos de vidrio
Cucharas, bisturíes, cuchillos y pinzas
Tubos de ensaye de 16 x 150 mm y de 20 x 100 mm
Tubos para serología de 10 x 75 mm o de 13 x 100 mm
Pipetas bacteriológicas de 10,0 y 5,0 ml, graduadas en 0,1 ml y protegidas con tapón de algodón
Pipetas de 1 ml, con graduaciones de 0,01 ml
Cajas de petri estériles de vidrio o desechables
Rejillas para tubos de ensaye
Asa de platino o nicromel de aproximadamente 3 mm de diámetro
Papel pH (intervalo de 6-8) con graduaciones máximas de 0,4 unidades de pH para cambios de color
Todo el material que tenga contacto con las muestras bajo estudio debe esterilizarse mediante:
Horno, durante 2 horas a 170-175ºC o autoclave, durante 15 min como mínimo a 121ºC ± 1ºC
7. Equipo
Horno para esterilizar que alcance los 180ºC
Incubadora con termostato para evitar variaciones mayores de ± 0,1ºC y termómetro
Autoclave con termómetro o manómetro, probado con termómetro de máximas
Baño maría con termostato y termómetro
Balanza granataria con sensibilidad de 0,1 g
Licuadora de una o dos velocidades controladas por un reóstato, con vasos esterilizables (vidrio o aluminio)
Mecheros Bunsen o Fisher
Potenciómetro
8. Procedimiento
8.1 Preparación de los alimentos para el aislamiento de Salmonella
Los siguientes métodos se basan en el análisis de 25 g de la muestra analítica en una proporción de 1:9 de muestra/caldo. Esta cantidad puede variarse siempre que se mantenga la misma proporción. Se recomienda una muestra de 25 g o más.
8.1.1 Procedimiento general para la preparación de muestras
Pesar asépticamente 25 g de la muestra en un vaso estéril de licuadora o en bolsa estéril para trabajar en homogeneizador peristáltico (stomacher). Adicionar 225 ml del medio de preenriquecimiento estéril (generalmente caldo lactosado, a menos que se indique otro) y licuar si es necesario durante un min. Transferir asépticamente la mezcla homogeneizada a un recipiente estéril de boca ancha con tapón de rosca y dejar reposar por 60 min a temperatura ambiente con la tapa bien enroscada. Mezclar bien y determinar el pH aproximado con papel pH. Ajustar, si es necesario, a un pH 6,8 ± 0,2 con hidróxido de sodio 1N o ácido clorhídrico 1N estériles. Mezclar y cubrir el recipiente enroscando suavemente la tapa.
Incubar 24 ± 2 h a 35ºC. Continuar como se indica en 8.2.1.
8.1.2 Procedimiento específico para la preparación de muestra según el producto
8.1.2.1 Huevo en polvo, claras de huevo en polvo, yema de huevo en polvo, huevos líquidos pasteurizados y congelados, fórmulas infantiles y mezclas preparadas en polvo (harinas para hot cakes, galletas, donas, bisquets y pan).
De preferencia no descongelar la muestra. Si se requiere, preparar los alimentos congelados justo antes de tomar la muestra analítica descongelándolos a 45ºC por 15 min aproximadamente con agitación constante en un baño de agua o por 18 h a una temperatura entre 2-5ºC. Los productos que no son en polvo se trabajan como indica el procedimiento general (8.1.1). Para los productos en polvo, pesar 25 g de muestra analítica en el medio de preenriquecimiento, dejando que el polvo se humecte lentamente. Si es necesario homogeneizando poco a poco con una varilla de vidrio estéril u otra herramienta también estéril. Continuar igual que el procedimiento general.
8.1.2.2 Productos no pasteurizados congelados de huevo
Descongelar la muestra como se indica en 8.1.2.1 Pesar asépticamente y por duplicado 25 g de muestra. Colocar en un matraz con 225 ml de caldo selenito cistina una de las muestras y la otra en un matraz con 225 ml de caldo tetrationato, sin verde brillante. Proceder como en 8.1.1 hasta ajustar el pH. Adicionar 2,25 ml de verde brillante al 0,1% y 4,5 ml de solución yodo-yoduro a la muestra contenida en el caldo tetrationato y mezclar bien. Incubar como se indica en 8.2.2.
8.1.2.3 Productos que contienen huevo en su formulación (pastas para sopa, rollos chinos, etc.); ensaladas preparadas (jamón, huevos, pollo, atún, pavo); frutas frescas, congeladas o secas; crustáceos (camarones, cangrejos, jaibas, langostinos, langostas) y pescado.
Preferentemente no descongelar la muestra antes de su análisis, si esto es necesario, proceder igual que en 8.1.2.1 utilizando caldo lactosado como medio de preenriquecimiento, licuar dos min. Continuar después de la incubación como en 8.2.1.
8.1.2.4 Leche en polvo, entera, semidescremada o descremada
Seguir el procedimiento general para el pesado de la muestra y adicionarla lentamente a un matraz Erlenmeyer con 225 ml de solución verde brillante al 0,1%, procurando que el polvo quede en la superficie del líquido y se hidrate suavemente. Dejar la mezcla en reposo por 60 min, e incubar como se indica en 8.1.1.
8.1.2.5 Queso
Proceder igual que en 8.1.1 utilizando agua de peptona tamponada como medio de preenriquecimiento.
8.1.2.6 Caseína
Seguir el procedimiento señalado en 8.1.1, licuar por dos min y ajustar cuidadosamente el pH.
8.1.2.7 Coco
Proceder como se indica en 8.1.1 hasta ajustar, si es necesario, el pH a los valores indicados. Adicionar hasta un máximo de 2,25 ml de Tergitol aniónico 7 estéril (121ºC ± 1ºC/15 min) y mezclar bien. Puede utilizarse Tritón X-100 estéril. Usar la cantidad necesaria de estos detergentes utilizando el volumen mínimo para que se inicie la formación de espuma. Puede ser, para el Tritón X-100 de dos a tres gotas. Incubar como se indica en 8.1.1.
8.1.2.8 Levadura seca
Seguir el procedimiento de 8.1.1, utilizando como medio de enriquecimiento caldo soya tripticasa estéril. Mezclar para formar una suspensión homogénea. Ajustar el pH y terminar el procedimiento como en 8.1.1.
Para levadura seca inactiva, continuar como en 8.2.1. Para levadura seca activa, mezclar la muestra incubada y transferir 1 ml a cada tubo de 10 ml de caldo tetrationato y 10 ml de caldo lauril triptosa. Incubar los medios selectivos por 24 ± 2 h. Continuar como se indica en 8.2.2.
8.1.2.9 Carnes, sustitutos de carnes, derivados cárnicos, sustancias de origen animal, productos glandulares y harinas (pescado, carne y hueso).
8.1.2.9.1 Productos procesados térmicamente y productos secos. Se sigue el procedimiento señalado en 8.1.1 hasta la homogeneización. Si la muestra es en polvo o molida, el licuado puede omitirse. Después de reposar, mezclar bien y ajustar el pH como se indica en el procedimiento general. Para emulsionar las grasas, agregar los detergentes en las mismas proporciones y con las mismas recomendaciones que para el coco. La cantidad de los mismos dependerá en gran medida de la composición del alimento. Los detergentes no serán necesarios en los productos glandulares en polvo. Incubar las muestras como se indica en 8.1.1.
8.1.2.9.2 Productos crudos o altamente contaminados. Pesar porciones de 25 g de producto en dos vasos para licuadora. Si la muestra es en polvo o molida, el licuado puede omitirse y el producto puede pesarse directamente en matraces Erlenmeyer estériles de 500 ml. Adicionar 225 ml de caldo selenito cistina o 225 ml de caldo tetrationato (sin verde brillante) a cada muestra analítica. Licuar por dos min y pasar asépticamente a matraces Erlenmeyer de 500 ml. Dejar reposar y ajustar el pH como se indica en 8.1.1.
Adicionar 2,25 ml de solución de verde brillante 0,1% y 4,5 ml de solución yodo-yoduro a la muestra que se enriquecerá con caldo tetrationato. Homogeneizar e incubar. Continuar como se indica en 8.2.1.
8.1.2.10 Dulces y dulces cubiertos (incluyendo chocolate)
Pesar asépticamente 25 g de la muestra en un vaso para licuadora agregando 225 ml de leche descremada reconstituida. Licuar por dos min. Manejar igual que en 8.1.1 hasta después de ajustar el pH. Adicionar 0,45 ml de la solución verde brillante al 0,1% y mezclar bien. Incubar como se indica en 8.1.1.
8.1.2.11 Especias
8.1.2.11.1 Pimienta negra, pimienta blanca, semilla de apio, comino, perejil seco, romero, tomillo, chile en polvo, paprika o pimentón, ajonjolí, hojuelas de vegetales (vegetales secos).
Pesar asépticamente 25 g de la muestra y verter en un recipiente de tapón de rosca de 500 ml con 225 ml de caldo soya tripticasa estéril y mezclar bien. Continuar con el procedimiento 8.1.1.
8.1.2.11.2 Ajo en polvo u hojuelas; cebolla en polvo u hojuelas
Pesar asépticamente 25 g de la muestra y verter en un recipiente de tapón de rosca de 500 ml con 225 ml de caldo soya tripticasa estéril adicionado con sulfito de potasio y mezclar bien. Continuar con el procedimiento 8.1.1.
8.1.2.11.3 Pimienta de Jamaica (Pimienta inglesa), clavo de especia, canela y orégano
No se conoce un método para neutralizar la toxicidad de estas cuatro especias. Diluir por lo tanto, más allá de su poder de toxicidad. Examinar la pimienta, canela y orégano en una proporción 1:100 muestra/ caldo, y el clavo a 1:1000 muestra/caldo. Seguir el procedimiento igual que en 8.1.2.11.1.
8.1.2.12 Gelatina
Pesar asépticamente 25 g de muestra en un recipiente de boca ancha y tapón de rosca de 500 ml. Adicionar 225 ml de caldo lactosado estéril con 5 ml de solución acuosa de gelatinasa al 5% y mezclar bien. Dejar reposar 60 min y continuar igual que el procedimiento 8.1.1.
8.2 Aislamiento de Salmonella
8.2.1 Cerrar firmemente el tapón de rosca de los matraces con los cultivos de preenriquecimiento y agitar suavemente, transferir respectivamente 1 ml de la mezcla a un tubo que contenga 10 ml de caldo tetrationato y a otro con 10 ml de caldo selenito cistina. Como alternativa, en sustitución del caldo tetrationato puede emplearse el medio Vassiliadis-Rappaport.
8.2.2 Incubar de 18 a 24 h a 35ºC o, para alimentos fuertemente contaminados a 42ºC por el mismo periodo. Estriar los productos que fueron directamente enriquecidos en medios selectivos.
8.2.3 Mezclar el tubo con caldo selenito cistina y estriar en agar xilosa lisina desoxicolato (XLD), agar verde brillante (VB) y una tercera caja con cualquiera de los medios selectivos adicionales (agar entérico Hektoen, agar Sulfito de Bismuto o Agar SS).
Efectuar el mismo procedimiento para el caldo tetrationato.
Incubar las placas 24 ± 2 h a 35ºC.
8.2.4 Examinar las placas para investigar la presencia de colonias típicas de Salmonella, de acuerdo con las siguientes características:
Agar XLD: colonias rosas o rojas que pueden ser transparentes con o sin centro negro. En algunos casos las colonias pueden aparecer completamente negras.
Agar VB: colonias rojas o rosas que pueden ser transparentes rodeadas por medio enrojecido; las bacterias fermentadoras de la lactosa dan colonias amarillas.
Agar entérico Hektoen: colonias verdes o azulverdes con o sin centro negro. En algunos casos las colonias pueden aparecer completamente negras.
Agar Sulfito de Bismuto: las colonias típicas de Salmonella pueden ser cafés, grises o negras; con o sin brillo metálico. Generalmente el medio circundante (halo) es café, tornándose posteriormente negro. Algunas cepas producen colonias verdes sin la formación del halo oscuro. Si las placas no muestran colonias típicas o no se observa crecimiento, incubar 24 h adicionales.
Agar SS: colonias translúcidas, ocasionalmente opacas. Algunas colonias dan centro negro. Las colonias fermentadoras de la lactosa son rojas.
8.3 Identificación bioquímica
8.3.1 Seleccionar al menos dos colonias típicas de cada medio selectivo, que se encuentren bien aisladas.
Tocar levemente el centro de cada colonia e inocular dos tubos, uno con agar triple azúcar hierro (TSI) y otro con agar hierro lisina (LIA), por estría en la superficie inclinada y por punción en el fondo.
Incubar por 24 ± 2 h a 35ºC.
Almacenar en refrigeración de 5 a 8ºC las placas con medios selectivos por si es necesario retomar más colonias.
8.3.2 Observar el crecimiento en los tubos y considerar presuntivamente positivas para Salmonella las colonias que den las siguientes reacciones:
8.3.2.1 Agar TSI, en el fondo del tubo se observa vire del indicador debido a la fermentación de la glucosa; en la superficie del medio se observa un color rojo más intenso que el medio original debido a la no fermentación de la lactosa ni de la sacarosa. En la mayoría de los casos se observa coloración negra a lo largo de la punción debido a la producción de ácido sulfihídrico.
8.3.2.2 Agar LIA, se observa intensificación del color púrpura en todo el tubo por la descarboxilación de la lisina. Considerar negativos aquellos cultivos que produzcan claramente color amarillo en el fondo del agar. La mayoría de las cepas de Salmonella producen ácido sulfihídrico en este medio con ennegrecimiento a lo largo de la punción.
8.3.2.3 Retener todos los cultivos que muestren las reacciones características de Salmonella en los medios TSI y LIA para las pruebas adicionales, indicadas en 8.3.3.
8.3.3 Los cultivos con TSI que no parecen de Salmonella pero que presentan reacciones en LIA típicos, deben trabajarse como cultivos presuntivos positivos, ya que en estos casos, el medio LIA permitirá detectar S. arizonae y cepas atípicas de Salmonella que utilicen lactosa o sacarosa. Descartar solamente los cultivos que muestren reacciones atípicas en ambos medios.
8.3.4 Continuar el análisis a partir de los tubos de TSI con reacciones típicas. Si el cultivo presenta reacciones atípicas en este medio, tomar colonias adicionales de las placas de donde se obtuvo el cultivo atípico anterior y sembrar las pruebas bioquímicas nuevamente.
8.3.5 Continuar la identificación bioquímica y serológica a partir de los cultivos recuperados de TSI. Se recomienda trabajar seis cultivos por cada 25 g de unidad analítica seleccionando colonias procedentes de ambos medios de enriquecimiento.
8.3.6 Prueba de ureasa
8.3.6.1 Prueba de ureasa (convencional). Con una asa estéril, tomar crecimiento del cultivo presumiblemente positivo de cada tubo de medio TSI e inocular tubos de caldo urea. Utilizar un control de medio para comparar el vire púrpura de las reacciones positivas con el color del medio original. Incubar 24 ± 2 h a 35ºC.
8.3.6.2 Prueba de ureasa (rápida). Tomar dos asadas de crecimiento del cultivo presumiblemente positivo de cada tubo de medio TSI e inocular tubos de caldo urea (rápida). Incubar 2 h a 37 ± 0,5ºC en baño de agua.
Descartar todos los cultivos que den ureasa positiva. Retener los cultivos que den la prueba negativa (sin cambio de color del medio).
8.4 Identificación serológica
8.4.1 Ensayo de los antígenos somáticos de Salmonella (Antisuero polivalente O)
8.4.1.1 Colocar con una asa dos gotas separadas de solución salina estéril sobre un portaobjetos o en dos secciones de una placa para aglutinación. Suspender en cada una de las gotas, una porción del cultivo desarrollado en TSI.
8.4.1.2 Agregar a una de ellas una gota del antisuero polivalente somático (O) y mezclar con el canto del asa o empleando aplicadores de madera.
8.4.1.3 Agitar inclinando la lámina hacia atrás y hacia adelante durante aproximadamente un min. Observar bajo buena iluminación sobre un fondo oscuro.
8.4.1.4 Considerar cualquier grado de aglutinación como positiva.
La prueba positiva resulta cuando se presenta aglutinación en la gota con el cultivo y el antisuero y no aglutinación en la gota que contiene el cultivo y la solución salina.
Si se observa aglutinación en ambas gotas, la prueba no es definitiva y se debe continuar con las pruebas bioquímicas complementarias.
8.4.2 Cuando la aglutinación es positiva con el suero polivalente O, puede determinarse el subgrupo empleando antisueros para los diferentes subgrupos (los grupos B, C, D y E, suelen ser los más frecuentes).
8.4.2.1 Si la aglutinación con el antisuero O es negativa, utilizar antisuero Vi y efectuar la prueba. Si hay aglutinación con Vi calentar el cultivo a ebullición y repetir la aglutinación con el antisuero polivalente O.
8.4.2.2 Si no se cuenta con los sueros grupoespecíficos, solicitar la tipificación de la cepa al Laboratorio de Enterobacterias del Centro Nacional de Diagnóstico y Referencia de la Secretaría de Salud o al Laboratorio Nacional de Salud Pública.
8.4.3 Si se requiere, practicar el ensayo de los antígenos flagelares de Salmonella (Antisuero polivalente H).
8.4.3.1 Inocular el crecimiento del tubo de TSI en agar infusión de cerebro corazón e incubar de 4 a 6 h a 35ºC hasta que se observe crecimiento (para ensayo en el mismo día), o bien, en caldo soya tripticaseina e incubar por 24 ± 2 h a 35ºC (para ensayo al día siguiente). Adicionar 2,5 ml de solución salina formalizada a 5 ml del cultivo en caldo o al cultivo en agar cerebro corazón (BHI).
8.4.3.2 Colocar 0,5 ml del antisuero polivalente flagelar (H) preparado en un tubo para serología (13 x 100 mm aproximadamente). Adicionar 0,5 ml del cultivo formalizado. Preparar un control de solución salina mezclando 0,5 ml de solución salina formalizada con 0,5 ml del antígeno formalizado. Incubar las mezclas en baño de agua a 48-50ºC. Observar a intervalos de 15 min por espacio de una h. Una prueba positiva es cuando se observa aglutinación en la mezcla de prueba pero no en el control. Debe interpretarse como negativa una prueba en la que ninguna de las mezclas muestre aglutinación. Cuando ambas mezclas se aglutinan, se considera la prueba inespecífica.
8.5 Pruebas bioquímicas complementarias
Cuando las pruebas serológicas o bioquímicas iniciales, dan resultados atípicos o no concluyentes, realizar las pruebas que se describen a continuación:
8.5.1 Inocular los cultivos positivos provenientes de TSI y LIA en: medio SIM, agar citrato de Simmons, caldo manitol y caldo RM-VP. Usar caldo malonato para confirmar la presencia de la especie S. arizonae.
8.5.2 Interpretar los cambios en los medios inoculados conforme lo siguiente:
8.5.2.1 Agar citrato Simmons
Inocular por estría el tubo.
Incubar 96 ± 2 h a 35 ± 2ºC.
Prueba positiva: crecimiento acompañado de un cambio de color de verde a azul.
Prueba negativa: ausencia de crecimiento y sin cambio de color.
8.5.2.2 Medio SIM
Inocular por punción.
Incubar 24 h a 35 ± 2ºC.
Movilidad.
Prueba positiva: crecimiento a lo largo de la punción y en el seno del medio de cultivo.
Prueba negativa: crecimiento a lo largo de la punción exclusivamente.
Producción de ácido sulfihídrico.
Prueba positiva: desarrollo de un color negro a lo largo de la punción que puede extenderse a todo el medio.
Prueba negativa: ausencia de color negro.
Producción de indol
Adicionar al tubo con medio SIM que presente crecimiento, de 0,2 a 0,3 ml de reactivo de Kovac.
Prueba positiva: desarrollo de un anillo de color rojo.
Prueba negativa: sin cambio de color.
8.5.2.3 Caldo RM-VP
Inocular un tubo con el medio.
Incubar 48 ± 2 h a 35 ± 2ºC para la prueba de VP y 96 h para la prueba RM.
8.5.2.3.1 Prueba de Voges-Proskauer (VP)
Transferir a un tubo un ml del cultivo de 48 h.
Adicionar 0,6 ml de solución de alfa naftol.
Adicionar 0,2 ml de solución de hidróxido de potasio 40%.
Adicionar algunos cristales de creatinina (opcional).
Interpretar los resultados después de incubar 2 h a 35 ± 2ºC o 4 h a temperatura ambiente.
Prueba positiva: desarrollo de color rojo ladrillo.
Prueba negativa: sin cambio de color.
Reincubar el resto del medio RM-VP 48 h más a 35 ± 2ºC.
8.5.2.3.2 Prueba de rojo de metilo (RM)
Adicionar al medio de cultivo de 96 h de incubación de dos a tres gotas de solución de rojo de metilo.
Interpretar los resultados inmediatamente.
Prueba positiva: desarrollo de color rojo.
Prueba negativa: desarrollo de color amarillo.
8.5.2.4 Caldo malonato
Inocular un tubo conteniendo el medio.
Incubar 40 ± 2 h a 35 ± 2ºC.
Prueba positiva: desarrollo de color azul.
Prueba negativa: sin cambio de color.
8.5.2.5 Caldo manitol
Inocular un tubo conteniendo el medio.
Incubar 24 ± 2 h a 35 ± 2ºC.
Prueba positiva: desarrollo de color amarillo.
Prueba negativa: sin cambio de color.
8.5.3 Consultar los resultados obtenidos en el cuadro 2 para la identificación de los géneros de las bacterias investigadas.
Nota: los sistemas bioquímicos comerciales validados pueden ser usados como alternativa para las pruebas bioquímicas convencionales.
9. Cálculo y expresión de resultados
9.1 Interpretación de reacciones bioquímicas y serológicas.
CUADRO 1
Reacciones Reacciones Interpretación
bioquímicas serológicas
Típica Antígeno O, Cepas consideradas
Vi o H positivo como Salmonella
Típica Todas las reacciones
negativas
Típica No probada Puede ser
Salmonella
Reacciones Antígeno O,
atípicas Vi o H
positivo
Reacciones Todas las No debe ser
atípicas reacciones considerada
negativas Salmonella
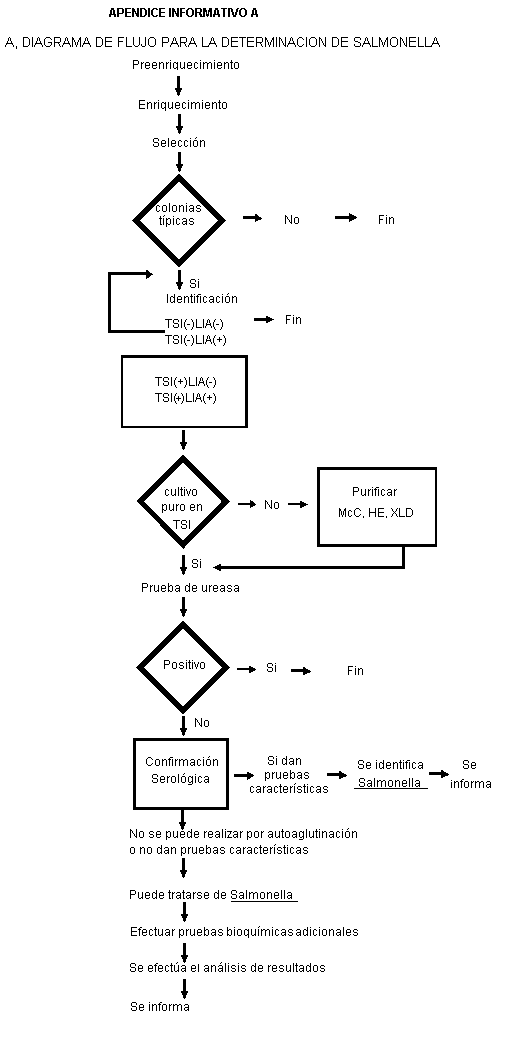
Nota: Ver apéndice informativo A.
9.2 Reacciones bioquímicas y serológicas de Salmonella
CUADRO 2
Prueba o sustrato Positivo Negativo Reacción
Glucosa (TSI) amarillo rojo +
Lisina descarboxilasa púrpura amarillo +
(LIA)
H2S (TSI y LIA) negro no negro +
Ureasa rojo-púrpura no hay cambio -
de color
Caldo de lisina púrpura amarillo +
descarboxilasa
Caldo dulcitol amarillo o gas no hay cambio +b
rojo de fenol de color ni gas
Caldo KCN crecimiento no hay -
crecimiento
Caldo malonato azul no hay cambio -c
de color
Prueba de indol superficie color superficie color -
violeta amarillo
Prueba del antígeno aglutinación no hay +
flagelar aglutinación
Prueba del antígeno aglutinación no hay +
somático aglutinación
Caldo lactosa amarillo o gas no hay cambio -c
rojo fenol de color ni gas
Caldo sacarosa amarillo o gas no hay cambio -
rojo fenol de color ni gas
Prueba Voges- de rosa a rojo no hay cambio -
Proskauer de color
Prueba rojo de metilo rojo difuso amarillo difuso +
Citrato de Simmons crecimiento no hay v
color azul crecimiento, no
hay cambio
de color
a +, 90% o más positivos en 1 o 2 días; -, 90% o más negativas en 1 o 2 días; v, variable.
b La mayoría de los cultivos S. arizonae son negativos.
c La mayoría de los cultivos S. arizonae son positivos.
9.3 Informe de resultados
Informar: presencia o ausencia de Salmonella en __________ g o ____________ ml de muestra.
10. Concordancia con normas internacionales
Esta norma no tiene concordancia con normas internacionales.
11. Bibliografía
11.1 Secretaría de Comercio y Fomento Industrial. 1992. Ley Federal sobre Metrología y Normalización. Diario Oficial de la Federación. México, D.F.
11.2 Secretaría de Salud. 1984. Ley General de Salud. Diario Oficial de la Federación. México, D.F.
11.3 Secretaría de Salud. 1988. Reglamento de la Ley General de Salud en Materia de Control Sanitario de Actividades, Establecimientos, Productos y Servicios.
11.4 Secretaría de Comercio y Fomento Industrial. NOM-008-SCFI-1993. Norma Oficial Mexicana. Sistema General de Unidades de Medida. México, D.F.
11.5 Amador L.R. y col. 1993. Manual de Laboratorio de Microbiología Sanitaria. IPN-ENCB. 2a. edición. pp. 139-153.
11.6 Ewing, W.H. y Ewing's. 1986. Identification of Enterobacteriaceae. 4th. Edition. Elsevier. New York.
11.7 ISO 6579. 1990. Microbiology-General guidance on methods for detection of Salmonella. International Organization for Standardization. Second edition.
11.8 Manual Difco. 1984. Medios de Cultivo Deshidratados y Reactivos para Microbiología. Difco Laboratories. Detroit Michigan USA. Décima edición. pp. 765, 946, 1042, 1044 y 1128.
11.9 Official Methods of Analysis. Association of Official Analytical Chemists (AOAC). 1990. Vol. I. 15th. Edition, USA. pp. 467-492.
11.10 Poelma L.P. y Silliker H.J. 1984. Salmonella; Compendium of Methods for the Microbiological Examination of Foods. Second Edition. American Public Health Association. Washington, DC. pp. 301-328.
11.11 Secretaría de Comercio y Fomento Industrial. Norma Z-013/02. 1981. Guía para la Redacción, Estructuración y Presentación de las Normas Oficiales Mexicanas. México, D.F.
11.12 Secretaría de Salud. 1992. Manual de Técnicas y Procedimientos para Análisis Microbiológico de leche en polvo. México, D.F. pp. 11-18.
11.13 Secretaría de Salud. 1989. Manual de Técnicas y Procedimientos para Análisis Microbiológico de productos cárnicos. México, D.F. pp. 15-24 y 28-30.
11.14 Wallace H.A.; Paul L.P. and Clyde R. W. 1984. Isolation and Identification of Salmonella Species. FDA. Bacteriological Analytical Manual. Chapter 7. 6th. Edition. pp. 7.01-7.18.
12. Observancia de la norma
La vigilancia del cumplimiento de la presente norma corresponde a la Secretaría de Salud.
13. Vigencia
La presente Norma Oficial Mexicana entrará en vigor con su carácter obligatoria a los treinta días siguientes a partir de su publicación en el Diario Oficial de la Federación.
Sufragio Efectivo. No Reelección.
México, D.F., a 10 de mayo de 1995.- El Director General, José Meljem Moctezuma.- Rúbrica.
APENDICE INFORMATIVO A

Fecha de publicación: 22 de septiembre de 1995
Si
quiere obtener una copia del texto completo, presione aquí ![]()