NORMA
Oficial Mexicana NOM-139-SSA1-1995, Que establece las especificaciones sanitarias de las bolsas para recolectar sangre.Al margen un sello con el Escudo Nacional, que dice: Estados Unidos Mexicanos.- Secretaría de Salud.
NORMA OFICIAL MEXICANA NOM-139-SSA1-1995, QUE ESTABLECE LAS ESPECIFICACIONES SANITARIAS DE LAS BOLSAS PARA RECOLECTAR SANGRE.
FRANCISCO J. HIGUERA RAMIREZ, Director General de Insumos para la Salud, por acuerdo del Comité Consultivo Nacional de Normalización de Regulación y Fomento Sanitario, con fundamento en los artículos 39 de la Ley Orgánica de la Administración Pública Federal; 13 apartado A fracción I, 194 fracciones I y II, 194 Bis, 195, 197, 201, 210, 212, 213, 214, 262 y demás aplicables de la Ley General de Salud; 3o. fracción XI, 38 fracción II, 40 fracciones I, V y XII, 41, 43, 52 y 62 de la Ley Federal sobre Metrología y Normalización; 2o., 8o., 9o., 18, 24 y demás aplicables del Reglamento de Insumos para la Salud; 10 fracción XII y 20 fracción III del Reglamento Interior de la Secretaría de Salud, y
CONSIDERANDO
Que con fecha 7 de diciembre de 1995, en cumplimiento de lo previsto en el artículo 46 fracción I de la Ley Federal sobre Metrología y Normalización, la Dirección General de Insumos para la Salud presentó al Comité Consultivo Nacional de Normalización de Regulación y Fomento Sanitario, el anteproyecto de la presente Norma Oficial Mexicana.
Que con fecha 13 de enero de 1997, en cumplimiento del acuerdo del Comité y de lo previsto en el artículo 47 fracción I de la Ley Federal sobre Metrología y Normalización, se publicó en el Diario Oficial de la Federación el proyecto de la presente Norma Oficial Mexicana, a efecto de que dentro de los siguientes noventa días naturales, posteriores a dicha publicación, los interesados presentaran sus comentarios ante el Comité Consultivo Nacional de Normalización de Regulación y Fomento Sanitario.
Las respuestas a los comentarios recibidos por el mencionado Comité, fueron publicadas previamente a la expedición de esta Norma en el Diario Oficial de la Federación, en los términos del artículo 47 fracción III de la Ley Federal sobre Metrología y Normalización.
Que en atención a las anteriores consideraciones, contando con la aprobación del Comité Consultivo Nacional de Normalización de Regulación y Fomento Sanitario, se expide la siguiente:
NORMA OFICIAL MEXICANA NOM-139-SSA1-1995, QUE ESTABLECE LAS ESPECIFICACIONES SANITARIAS DE LAS BOLSAS PARA RECOLECTAR SANGRE
PREFACIO
Las Unidades Administrativas que participaron en la elaboración de esta Norma son: Dirección General de Insumos para la Salud; las Instituciones: Cámara Nacional de la Industria de la Transformación (CANACINTRA): Consejo Paramédico, Cámara Nacional de la Industria Farmacéutica (CANIFARMA): Sección de Productos Auxiliares para la Salud, Escuela Nacional de Ciencias Biológicas del I.P.N., Facultad de Medicina de la UNAM, Hospital Infantil de México "Federico Gómez" de la SSA, Unidad de Control Técnico de Insumos del Instituto Mexicano del Seguro Social y los establecimientos siguientes: Baxter, S.A. de C.V., Corpore, S.A. de C.V., Grupo Grifols de México, S.A. de C.V., Industrias Médicas, S.A. de C.V., Itochu México, Laboratorios Pisa, S.A. de C.V. y Terumo Medical de México.
INDICE
1. Objetivo y campo de aplicación.
2. Referencias.
3. Definiciones, símbolos y abreviaturas.
4. Clasificación y designación del producto.
5. Descripción del producto.
6. Nomenclatura de materiales.
7. Especificaciones.
8. Muestreo.
9. Análisis de laboratorio.
10. Marcado, empaque y embalaje.
11. Almacenamiento y distribución.
12. Bibliografía.
13. Concordancia con normas internacionales y mexicanas.
14. Observancia de la Norma
15. Vigencia.
1. Objetivo y campo de aplicación
1.1 Objetivo.
Esta Norma establece las especificaciones sanitarias que deben cumplir las Bolsas para Recolectar Sangre y señala los métodos de prueba para la verificación de las mismas.
1.2 Campo de aplicación.
Esta Norma es de observancia obligatoria en todo el territorio nacional para todas las industrias, laboratorios y establecimientos dedicados a la fabricación, importación y distribución de las bolsas para recolectar sangre.
2. Referencias
Para la correcta aplicación de esta Norma, es conveniente consultar las siguientes Normas Oficiales Mexicanas:
2.1 NOM-015-SSA1-1993, Equipo para transfusión con filtro sin aguja.
2.2 NOM-068-SSA1-1993, Que establece las especificaciones sanitarias de los instrumentos quirúrgicos, materiales metálicos de acero inoxidable.
2.3 NOM-008-SCFI-1993, Sistema General de Unidades de Medida.
3. Definiciones, símbolos y abreviaturas
3.1 Definiciones.
Para efectos de esta Norma, se entiende por:
3.1.1 Plástico grado médico.
Polímeros o copolímeros, naturales o sintéticos, los cuales son procesados mediante formulaciones específicas que garantizan la atoxicidad del producto.
3.1.2 Látex grado médico.
Látex procesado mediante formulaciones específicas que garantizan la atoxicidad del producto.
3.2 Símbolos y abreviaturas.
USP The United States Pharmacopeia
BP British Pharmacopeia
% por ciento
cm centímetro
cm² centímetro cuadrado
g gramo
mL mililitro
SWG Standard Wire Gauge
![]() coeficiente de extinción
coeficiente de extinción
N Newton
kgf kilogramo fuerza
MPa Megapascal
m/s² metro por segundo cuadrado
m/v masa sobre volumen
°C grado Celsius
K grado Kelvin
ISO International Organization for Standardization
DIN Deustches Institut für Normüng
AISI American Iron and Steel Institute
ACD Acido cítrico, Citrato de sodio, Dextrosa
CPD Citrato de sodio, Fosfato de sodio, Dextrosa
CDPA Citrato de sodio, Dextrosa, Fosfato de sodio, Adenina
FEUM Farmacopea de los Estados Unidos Mexicanos
G Gauge
kPa Kilopascal
mm milímetro
mg miligramo
MGA Métodos Generales de Análisis
pH Concentración de hidrogeniones
ppm partes por millón
Rh Antígenos D de los Eritrocitos
VDRL Venereal Disease Research Laboratory
VIH Virus de Inmunodeficiencia Humana
Xg fuerza centrífuga
4. Clasificación y designación del producto
4.1 Clasificación.
Tipo I
Una bolsa para recolectar sangre de 450 - 500 mL con 67.5 o 75 mL de solución ACD y un tubo colector integral con aguja No. 15 o No. 16.
Tipo II
Una bolsa para recolectar sangre de 400 - 500 mL con 63 o 70 mL de solución CPD y un tubo colector integral con aguja No. 15 o 16.
Tipo III
Una bolsa para recolectar sangre de 400 - 500 mL con 63 o 70 mL de solución CPDA 1 y un tubo colector integral con aguja No. 15 o No. 16.
TABLA 1.- SOLUCIONES ANTICOAGULANTES
|
TIPO |
SOLUCION ANTICOAGULANTE |
CONTENIDO |
|
I I' |
ACD FORMULA A ACD FORMULA B |
67.5 o 75.0 mL 112.5 o 125 mL |
|
II |
CPD |
63 o 70 mL |
|
III |
CPDA 1 |
63 o 70 mL |
5. Descripción del producto
Bolsa para recolectar sangre: Recipiente hermético elaborado a base de cloruro de polivinilo o cualquier otro material plástico, grado médico, sin pigmentar, flexible, transparente o translúcido, inodoro o con un ligero olor característico delimitado por un termosellado doble, la parte superior debe llevar ensamblados y sellados herméticamente tres o cuatro tubos cortos de los cuales uno o dos están obturados en el interior y protegidos mediante un dispositivo para mantenerlos estériles. De los tubos restantes uno se conecta al equipo de punción. La porción inferior de la bolsa debe tener una o más ranuras que permitan colgar la bolsa durante su uso y las partes laterales una o dos ranuras cuya función será fijar adecuadamente los tubos transportadores durante el proceso de centrifugación de la sangre. La bolsa debe contener solución anticoagulante.
5.1 Solución anticoagulante.
No debe contener agentes antimicrobianos.
(* y **) Fórmula de la solución ACD (ácido cítrico, citrato de sodio y dextrosa).
Cada 1000 mL contienen:
Solución A Solución B
Acido cítrico (anhidro) 7.3 g 4.4 g
Si es acido cítrico
monohidratado 8.0 g 4.8 g
Citrato de sodio
(dihidratado) 22.0 g 13.2 g
Dextrosa (monohidratada) 24.5 g 14.7 g
Agua para inyección una cantidad
suficiente para hacer 1000 mL 1000 mL
Para cada 100 mL de
sangre recolectada 15 mL 25 mL
(* y **) Fórmula de la solución CPD (citrato de sodio, ácido cítrico, fosfato de sodio monobásico y dextrosa).
Cada 1000 mL contienen:
Acido cítrico (anhidro) 3.27 g
Citrato de sodio (dihidratado) 26.30 g
Fosfato de sodio monobásico
(monohidratado) 2.51 g
Dextrosa (monohidratada) 25.50 g
Agua para inyección, una cantidad
suficiente para hacer 1000 mL
Para cada 100 mL de sangre recolectada 14 mL
(* y **) Fórmula de la solución CPDA 1 (citrato de sodio, ácido cítrico, fosfato de sodio monobásico, dextrosa y adenina).
Cada 1000 mL contienen:
Acido cítrico (monohidratado) 3.27 g
Citrato de sodio (dihidratado) 26.30 g
Fosfato de sodio monobásico
(monohidratado) 2.51 g
Dextrosa (monohidratada) 31.75 g
o
Dextrosa (anhidra) 29.0 g
Adenina 0.275 g
Agua para inyección, una cantidad
suficiente para hacer 1000 mL
Para cada 100 mL de sangre recolectada 14.0 mL
* Las formulaciones pueden ser sustituidas por las indicadas en las Farmacopeas vigentes en los países fabricantes.
** El grado de hidratación de las sales puede cambiar, conservando la equivalencia.
5.2 Tubos cortos.
Piezas de plástico flexible, transparente o translúcido. Uno de los tubos cortos debe tener ensamblado un tubo transportador. Los tubos restantes deben estar obturados con un diafragma de plástico para punción, no resellable, provistos de protectores que mantengan su esterilidad. La posición y tamaño de estos tubos cortos debe ser tal que no se presenten fugas durante la inserción de la bayoneta del equipo para transfusión en los mismos, ni durante su uso.
5.3 Protectores.
Deben impedir la entrada de aire al equipo, proteger y mantener la esterilidad interior de los tubos cortos, del equipo y la interior y exterior de la aguja. Deben estar diseñados de tal forma que se remuevan con facilidad, revelando claramente esta acción, y no puedan volver a su posición original. El protector de la aguja puede ser de látex natural o pigmentado, o de plástico semirígido, el cual puede estar provisto de un protector de látex. Los protectores de los tubos cortos deben ser de plástico.
5.4 Tubo transportador.
Piezas de plástico flexible, transparente o translúcido, sin pigmentar, por un extremo lleva ensamblado el pabellón de la aguja y por el otro ensambla a uno de los tubos cortos de la bolsa.
5.5 Obturador (que puede o no estar integrado al equipo).
Pieza de plástico, cuya función es colapsar totalmente al tubo transportador, una vez conseguido, debe permanecer firme y sin movimiento. No debe dañar a los componentes del artículo durante el uso normal del equipo, ni durante su almacenamiento. Debe venir ensamblado al tubo transportador o contenido dentro del empaque primario.
5.6 Aguja de punción.
Cánula de acero inoxidable con un extremo terminado en punta y por el otro ensamblada a un pabellón de dimensiones adecuadas para su fácil manipulación.
6. Nomenclatura de materiales
A continuación se indica la nomenclatura y su equivalencia con la de otros organismos.
DIN ISO BSI AISI
X5CrNi189(1810) 11 M 304
X5CrNiMo1810(17122) 20 P 316
X2CrNiMoN18154 Composición E - 316 - L
X15Cr13 3 A 410
416
7. Especificaciones
DETERMINACION ESPECIFICACION
Acabado Debe estar libre de deformaciones, burbujas, oquedades, rebabas, rugosidades, roturas, desmoronamientos, material infusible, material extraño, piezas desensambladas, piezas faltantes, delgadas o chiclosas, bordes filosos en el plástico, colapsamientos y desechos de pulido. La aguja no debe tener corrosión a simple vista, marcas de esmerilado, poros, partes romas en el filo, fracturas, áreas rugosas, muescas, rayas, desechos de pulido, grietas, superposición de materiales, deformación de la cánula, deformaciones en el bisel, debe tener un acabado final a espejo o satinado. Las superficies internas del producto no deben permitir la adherencia entre las paredes de la bolsa ni favorecer el atrapamiento de células. La superficie del producto debe ser de color uniforme (cuando sean coloreadas). La bolsa, los tubos cortos y el tubo transportador deben ser transparentes o translúcidos.
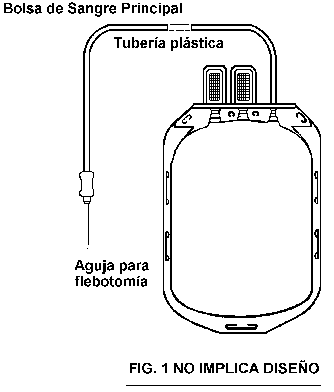
(***) Dimensiones
(ver figura 1).
Del tubo transportador
primario mm - Longitud 800 a 1260
- Diámetro Interno 2.7 a 3.2
- Diámetro Externo 3.4 a 4.8
De la Bolsa
Almacenadora, mm
- Ancho Util (A) para:
450 mL 100.0 a 128.0
500 mL 100.0 a 140.0
- Longitud Util (B) para:
450 mL 154.0 a 220.0
500 mL 154.0 a 220.0
- Espesor a Pared
Sencilla, mm 0.35 mínimo
De la Aguja de Punción
- Longitud Util, mm
34.0 a 39.0
- Diámetro Exterior, mm
Calibre 15 (SWG) 1.75 a 1.90
Calibre 16 (SWG) 1.60 a 1.69
-Diámetro Interior, mm
Calibre 15 (SWG) 1.30 a 1.56
Calibre 16 (SWG) 1.15 a 1.50
- Longitud del Bisel, mm
Calibre 15 4.75 a 5.55
Calibre 16 5.50 a 6.73
Capacidad Total de la
Bolsa Primaria, mL
Para 450 mL 513.0 mínimo
Para 500 mL 563.0 mínimo
Volumen de la Solución
Anticoagulante mL
Para 63 mL 56.7 a 69.3
Para 67.5 mL 60.75 a 74.25
Para 70 mL 63.0 a 77.0
Para 75 mL 67.5 a 82.5
(***) Las dimensiones anteriores pueden ser sustituidas por las indicadas en las Farmacopeas vigentes en los países fabricantes.
Resistencia a la Centrifugación |
No se deben presentar signos de fugas sobre el papel indicador ni ocurrir una distorsión permanente. |
Permeabilidad al vapor |
La pérdida de masa no debe exceder del 2% de la masa total. |
Estabilidad Térmica |
La bolsa debe cumplir con las determinaciones de resistencia a la centrifugación, permeabilidad al vapor, resitencia a la compresión, fugas, vaciamiento bajo presión y la de velocidad de llenado. |
Indice Hemolítico |
La solución del primer tubo debe tener un índice hemolítico de no más del 10% y el índice hemolítico del segundo tubo no debe diferir por más del 10% del índice hemolítico correspondiente al tercer tubo. |
Resistencia del Dispositivo de Suspensión |
No debe romperse ni presentar deterioro. |
Resistencia de los Ensambles N (kgf) |
34.10 (3.5) mínimo para partes pegadas. 14.70 (1.5) mínimo para partes ensambladas. |
Prueba de esterilidad |
Debe satisfacer la prueba. |
Vaciamiento Bajo Presión |
La bolsa debe vaciarse en 2 minutos, máximo. |
Velocidad de Llenado |
La bolsa debe llenarse, al menos a su capacidad nominal, en 8 minutos. |
Fugas |
No deben tener signos de fugas el papel indicador ni la bolsa. |
Material Oxidable |
La diferencia entre los volúmenes de la solución titulante usada en la solución de la muestra y en el blanco no debe ser mayor de 2 mL. |
Amonio |
El color desarrollado por el extracto de la muestra no debe ser más intenso que el obtenido en la solución de referencia de amonio. |
Fósforo Orgánico |
El color producido por la muestra no debe ser más intenso que el de la solución blanco. |
pH |
El pH del extracto debe ser de 4.5 a 7.0. |
Residuo a la Evaporación. |
La masa residual del extracto no debe exceder a la del blanco por más de 3.0 mg. |
Claridad y Color |
El extracto debe ser tan claro e incoloro como el del blanco. |
Resistencia del Marcado Etiquetado |
La etiqueta no se debe despegar de la bolsa y la impresión sobre ésta debe ser legible e indeleble. |
Impreso |
La impresión directa sobre la bolsa debe ser legible e indeleble. |
Resistencia a la Tensión en las Bolsas MPa |
17.02 MPa mínima (175 kgf/cm²) |
Elongación en las Bolsas % |
200 mínimo |
Pirógenos |
No pirogénico |
Prueba de Seguridad* |
Debe satisfacer la prueba |
Prueba de Inyección Sistémica* |
Debe satisfacer la prueba |
Prueba Intracutánea* |
Debe satisfacer la prueba |
Prueba de Implantación* |
Debe satisfacer la prueba |
Metales Pesados, ppm* |
Plásticos 1 máximo Hules 5 máximo |
AGUJA Identificación del Material de Fabricación |
Acero Inoxidable BSI M-P-E |
Composición Química |
Debe cumplir la especificación |
Dureza Rockwell-C |
34 Rockwell-C a 42 Rockwell-C |
Resistencia a la corrosión |
A simple vista no deben tener indicios de corrosión |
Deflexión |
Calibre 15: No debe ser mayor de 0.45 mm Calibre 16: No debe ser mayor de 0.30 mm |
ANTICOAGULANTES Aspecto |
La solución anticoagulante debe ser transparente y libre de partículas visibles |
Identidad de: Fosfatos, sodio y citratos |
Positiva |
Dextrosa |
Positiva |
Esterilidad |
Debe ser estéril |
Cloruros, % pH |
0.0035 máximo |
Solución ACD |
4.5 a 5.5 |
Solución CPD |
5.0 a 6.0 |
Solución CPDA |
5.0 a 6.0 |
Valoración de los componentes |
95% a 105% de lo indicado en la fórmula, excepto adenina en CPDA que será de 90% a 110%. |
8. Muestreo
8.1
Selección de la muestra.Para efectos de muestreo e inspección, se recomienda proceder de acuerdo con la NMX-Z-12-1987, Muestreo para la inspección por atributos.
8.2 Clasificación de defectos.
8.2.1 Críticos.
En el producto.
- Material extraño dentro del producto.
- Leyendas de un producto diferente en la bolsa.
- En el caso de que el empaque sea transparente se deben determinar los siguientes defectos:
- Numeración diferente en el tubo.
- Piezas rotas.
- Piezas faltantes.
- Piezas desensambladas.
- Tubos o bolsas no transparentes o no translúcidos.
- Solución anticoagulante no transparente.
En el empaque.
- Empaque primario o múltiple mal sellado, roto o abierto.
- Leyendas de un producto diferente en el empaque primario o múltiple.
- Fecha de caducidad ausente, equivocada, vencida o ilegible en empaque primario o múltiple (2 años mínimo de vigencia desde el momento de la fabricación).
- Ausencia del total de datos o leyendas o si está ausente o ilegible alguno de los siguientes en empaque primario o múltiple.
. Bolsa para almacenar sangre con ACD, CPD o CPDA.
. Número de registro otorgado por la SSA.
. Número de lote.
. Libre de pirógenos.
. Marca o logotipo, razón social o nombre y domicilio del fabricante, importador y proveedor.
. Calibre de la aguja.
. Fecha de fabricación, puede estar implícita en el número de lote.
. Desechable (o leyendas alusivas).
. Material extraño fuera del equipo.
8.2.2 Mayores.
En el empaque.
- Empaque primario o múltiple sucio, manchado o deteriorado.
- Material extraño fuera del equipo.
- Si está ausente o ilegible alguno de los siguientes datos o leyendas en empaque primario o múltiple:
. Nombre genérico del producto.
. Producto estéril.
. No se garantiza la esterilidad del producto en caso de que el empaque haya sufrido ruptura previa (o leyendas alusivas).
. Cantidad de bolsas.
. Fórmula de la solución anticoagulante.
8.2.3 Menores.
En el empaque.
- Si está ilegible o ausente el dato de país de origen en empaque primario o múltiple.
- Si está borroso pero legible alguno de los datos o leyendas mencionados en defectos críticos, mayores o menores.
- Etiquetas rotas, desgarradas o mojadas pero con información legible y completa en el empaque primario o múltiple.
- No cumplir con otros requisitos de etiquetado indicados por las Normas Oficiales Mexicanas específicas para dispositivos de uso médico.
9. Análisis de laboratorio
9.1 Selección de la muestra.
Para pruebas de laboratorio seleccionar al azar un mínimo de 75 bolsas, provenientes de un mismo lote.
9.2 Métodos de prueba.
Los aparatos utilizados deben estar debidamente calibrados. Emplear agua destilada, reactivos grado analítico y material de vidrio borosilicato de bajo coeficiente de expansión térmica, a menos que se señalen otras condiciones.
Las soluciones volumétricas y de prueba deben prepararse como se indica en la FEUM 6a. Edición 1994, en los MGA 0831 y MGA 0851.
Utilizar un mínimo de 12 bolsas para cada determinación, con excepción de los métodos donde se indique el número de piezas a probar.
9.2.1 Acabado.
PROCEDIMIENTO
Inspeccionar a simple vista.
INTERPRETACION
Debe estar libre de deformaciones, burbujas, oquedades, rebabas, rugosidades, roturas, desmoronamientos, material extraño, piezas desensambladas, piezas faltantes, partes delgadas o chiclosas, bordes filosos en el plástico, colapsamientos. La aguja no debe tener corrosión a simple vista, fracturas, muescas, áreas rugosas, marcas de esmerilado, poros, partes romas en el filo, rayas, desechos de pulido, grietas, superposición de material, deformación de la cánula, deformaciones en el bisel; debe tener un acabado final a espejo o satinado. Las superficies del producto deben ser lisas y de color uniforme (cuando sean coloreadas). La bolsa, los tubos cortos y el tubo transportador deben ser transparentes o translúcidos.
9.2.2 Dimensiones, capacidad total de la bolsa y volumen del anticoagulante.
PROCEDIMIENTO
Para dimensiones, utilizar una regla metálica, un micrómetro y un Vernier para medir longitudes, espesores y diámetros (ver figura 1). Para determinar el volumen del anticoagulante, tomar 5 bolsas, sujetar la cánula por el pabellón y quitar el protector de la misma, permitir la entrada de aire y dejar que la solución descienda hasta la bolsa, cortar el tubo transportador lo más cercano a la cánula, introducir aire, y reunir la solución hacia un lado, sujetar la bolsa por el tubo transportador, girarla en el aire y recibir la solución anticoagulante en una probeta graduada debidamente calibrada. Para determinar la capacidad total de la bolsa adicionar un volumen de agua, sin vaciar el anticoagulante, de acuerdo con lo etiquetado para cada bolsa.
INTERPRETACION
Las muestras deben cumplir con lo establecido en el numeral 7 en dimensiones.
9.2.3 Resistencia a la centrifugación.
REACTIVOS
* Solución de ácido clorhídrico 2 M.
* Solución de hidróxido de sodio 0.02 M.
* Azul de bromofenol.
SOLUCION ACUOSA DE AZUL DE BROMOFENOL
Disolver 50 mg de azul de bromofenol, con calentamiento suave, en 3.73 mL de la solución de hidróxido de sodio, diluir a 100 mL con agua.
PROCEDIMIENTO
Llenar la bolsa a su capacidad nominal con agua previamente acidificada con 1 mL de la solución de ácido clorhídrico. Envolver la bolsa con papel absorbente seco, previamente impregnado con la solución acuosa de azul de bromofenol diluida 5 veces su volumen, o con otro indicador adecuado. Centrifugar a 49033.25 m/s2 (5000 g) durante 10 minutos.
INTERPRETACION
No se deben presentar signos de fugas sobre el papel indicador, ni ocurrir una distorsión permanente.
9.2.4 Permeabilidad al vapor.
REACTIVOS
Solución de cloruro de sodio al 0.9% m/v.
PROCEDIMIENTO
Llenar las bolsas, conteniendo el anticoagulante, a su capacidad nominal con la solución de cloruro de sodio, cerrar, pesar y almacenar a una temperatura de 277 K a 279 K (4°C a 6°C) con una humedad relativa del 45% al 55% durante 21 días, volver a pesar.
INTERPRETACION
La pérdida de masa no debe exceder el 1% de la masa total.
9.2.5 Estabilidad térmica.
REACTIVOS
Solución de cloruro de sodio al 0.9% m/v.
PROCEDIMIENTO
Llenar la bolsa, conteniendo el anticoagulante, a su capacidad nominal con la solución de cloruro de sodio, almacenar 24 horas a una temperatura de 195 K a 191 K (-78°C a -82°C), inmediatamente después almacenar 24 horas de 321 K a 325 K (48°C a 52°C) y después llevar a temperatura ambiente.
INTERPRETACION
La bolsa debe cumplir con las determinaciones de resistencia a la centrifugación, permeabilidad al vapor, resistencia a la compresión, fugas, vaciamiento bajo presión y la de velocidad de llenado.
9.2.6 Indice hemolítico.
REACTIVOS
Cloruro de sodio.
Ortofosfato disódico hidrogenado.
Ortofosfato de sodio hidrogenado.
Sangre humana heparinizada, de no más de 3 horas de recolectada.
SOLUCION DE REFERENCIA
Pesar 90.00 g de cloruro de sodio, 34.60 g de ortofosfato disódico hidrogenado y 2.48 g de ortofosfato de sodio hidrogenado, transferir a un matraz volumétrico de 1000 mL, disolver y aforar con agua, mezclar.
PREPARACION DE LA MUESTRA
Vaciar la bolsa primaria, lavarla con 250 mL de agua para inyección a una temperatura entre 292 K y 294 K (19°C y 21°C), desechar los lavados. Adicionar al artículo un volumen de agua para inyección correspondiente al volumen de anticoagulante indicado en la etiqueta, circular el agua a través del artículo, cerrar, calentar en autoclave manteniendo la temperatura a 383 K (110°C) durante 30 minutos. Enfriar y adicionar suficiente agua para inyección hasta llenar el artículo a su capacidad nominal (solución A).
PROCEDIMIENTO
Preparar tres soluciones con la solución de referencia como sigue: Solución (1) agregar 10 mL de agua y 30 mL de la solución de referencia. Solución (2) agregar 20 mL de agua y 30 mL de solución de referencia. Solución (3) agregar 85 mL de agua y 15 mL de solución de referencia. Adicionar, a cada uno de tres tubos de centrífuga, 1.4 mL de solución A y 0.02 mL de sangre humana heparinizada, al primer tubo adicionar 0.1 mL de la solución (1), al segundo tubo adicionar 0.1 mL de la solución (2) y al tercer tubo adicionar 0.1 mL de la solución (3), respectivamente, mezclar bien y calentar en baño de agua entre 302 K y 304 K (29°C y 31°C) durante 40 minutos. Preparar también otras tres soluciones como sigue: Solución (4) agregar 12 mL de agua y 3 mL de solución (1). Solución (5) agregar 11 mL de agua y 4 mL de solución (2). Solución (6) agregar 1.25 mL de agua y 4.75 mL de solución (2). Adicionar a la Solución (4) 1.5 mL de la solución (1), a la Solución (5) 1.5 mL de la solución (2) y la Solución (6) 1.5 mL de la solución (3). Al mismo tiempo y de igual forma preparar otros tres tubos pero usando agua en lugar de la solución A. Centrifugar simultáneamente los 6 tubos a exactamente 24516.62 m/s2 (2500 Xg) en una centrífuga horizontal durante 5 minutos. Después de centrifugar determinar la absorbancia de cada una de las soluciones a una longitud de onda de 540 mm, emplear celdas de 1 cm y la solución de referencia para ajustar el aparato.
Calcular el índice hemolítico en porcentaje, por medio de la siguiente fórmula:
100 (A/A3)
donde:
A = Absorbancia del primero y segundo tubos o del tubo control correspondiente
A3 = Absorbancia del tercer tubo
La solución del primer tubo debe tener un índice hemolítico de no más del 10% y el índice hemolítico del segundo tubo no debe diferir por más del 10% del índice hemolítico correspondiente al tercer tubo.
9.2.7 Resistencia del dispositivo de suspensión.
REACTIVOS
Solución de ácido clorhídrico 2 M.
PROCEDIMIENTO
Llenar la bolsa, conteniendo el anticoagulante, a su capacidad nominal con agua previamente acidificada con 1 mL de la solución de ácido clorhídrico. Suspenderla por medio del dispositivo de suspensión, aplicar inmediatamente una fuerza de 25 N (2.55 kgf) a lo largo del eje del tubo transportador primario, manteniendo la tracción por 5 segundos. Repetir esta determinación con la fuerza y tiempo mencionados a cada una de las partes de llenado y vaciado de la bolsa.
INTERPRETACION
No debe romperse, ni presentar deterioros.
9.2.8 Resistencia de los ensambles.
PROCEDIMIENTO
Utilizar una máquina universal de pruebas mecánicas bajo las siguientes condiciones: Velocidad de prueba 100 mm/minuto, aplicando una fuerza de tensión de 34.10 N (3.5 kgf) para partes pegadas y 14.71 N (1.5 kgf) para partes ensambladas durante 15 segundos, temperatura de 293 K a 300 K (20°C a 27°C).
INTERPRETACION
La fuerza mínima que deben soportar los ensambles son:
Para partes pegadas: 34.10 N (3.5 kgf).
Para partes ensambladas: 14.71 N (1.5 kgf).
9.2.9 Vaciamiento bajo presión.
PROCEDIMIENTO
Llenar la bolsa, conteniendo el anticoagulante, a su capacidad nominal con agua, a una temperatura de 277 K a 279 K (4°C a 6°C) ensamblar un equipo para transfusión, sin cánula intravenosa, a uno de los tubos cortos. Comprimir la bolsa manteniendo una presión de 40 kPa (0.41 kgf/cm2), durante todo el vaciamiento.
INTERPRETACION
La bolsa debe vaciarse en 2 minutos máximo.
9.2.10 Velocidad de llenado.
REACTIVOS
Solución de sacarosa al 33.5% m/v.
PROCEDIMIENTO
Ensamblar la bolsa, por medio de la aguja de punción, a un recipiente que contenga una solución con una viscosidad igual a la de la sangre [la solución de sacarosa a una temperatura de 310 K (37°C) es adecuada. Mantener la presión interna del recipiente a 9.3 kPa (0.096 kgf/cm2)¡Error!No se encuentra el origen de la referencia., con la base de éste y la parte superior de la bolsa al mismo nivel.
INTERPRETACION
La bolsa debe llenarse, al menos a su capacidad nominal, en 8 minutos.
9.2.11 Fugas.
REACTIVOS
. Azul de bromofenol.
. Solución de hidróxido de sodio 0.02 M.
SOLUCION ACUOSA DE AZUL DE BROMOFENOL:
Preparar como se indica en el numeral 9.2.3 de esta Norma.
PROCEDIMIENTO
Colocar la muestra utilizada en la determinación de resistencia al dispositivo de suspensión entre 2 placas cubiertas con papel absorbente seco, previamente impregnado con la solución acuosa de azul de bromofenol, diluida a 5 veces su volumen, o algún otro indicador adecuado. Aplicar una fuerza progresivamente, hasta que la presión interna de la muestra (ésta es la diferencia entre la presión aplicada y la presión atmosférica) alcance 67 kPa (0.69 kgf/cm2) en un minuto, mantener la presión por 10 minutos.
INTERPRETACION
No deben tener signos de fugas el papel indicador, ni la bolsa.
9.2.12 Materia oxidable.
PROCEDIMIENTO
Realizar esta determinación de acuerdo con el método C establecido en la Norma BS 2463 (12.16).
INTERPRETACION
La diferencia entre los volúmenes de la solución titulante usada en la solución de la muestra y en el blanco no debe ser mayor de 2 mL.
9.2.13 Amonio.
PROCEDIMIENTO
Realizar esta determinación de acuerdo con el método C establecido en la Norma BS 2463 (12.16).
INTERPRETACION
El color desarrollado por el extracto de la muestra no debe ser más intenso que el obtenido en la solución de referencia de amonio.
9.2.14 Fósforo orgánico.
PROCEDIMIENTO
Realizar esta determinación de acuerdo con el método C establecido en la Norma BS 2463 (12.16).
INTERPRETACION
El color producido por la muestra no debe ser más intenso que el de la solución blanco.
9.2.15 pH de la bolsa y de la solución anticoagulante.
PREPARACION DEL EXTRACTO DE LA BOLSA
Proceder de acuerdo con lo establecido en la BS 2463 (12.16).
PROCEDIMIENTO
Proceder de acuerdo con lo establecido en el método MGA 0701 de la FEUM 6a. Edición 1994, con la preparación del extracto o con la solución anticoagulante.
INTERPRETACION
El pH debe ser:
Para el extracto de la bolsa:
4.5 a 7.0.
Para la solución anticoagulante:
ACD de 4.5 a 5.5
CPD de 5.0 a 6.0
CPDA de 5.0 a 6.0
9.2.16 Residuo a la evaporación.
PROCEDIMIENTO
Realizar esta determinación de acuerdo con el método C establecido en la Norma BS 2463 (12.16).
INTERPRETACION
La masa residual del extracto no debe exceder a la del blanco por más de 3.0 mg.
9.2.17 Claridad y color.
PROCEDIMIENTO
Realizar esta determinación de acuerdo con el método C establecido en la Norma BS 2463 (12.16).
INTERPRETACION
El extracto debe ser tan claro e incoloro como el blanco.
9.2.18 Resistencia del marcado.
PROCEDIMIENTO
Realizar esta determinación de acuerdo con el método establecido en la Norma BS 2463 (12.16).
INTERPRETACION
Etiquetado:
La etiqueta no debe despegarse de la bolsa y la impresión sobre ésta debe ser legible e indeleble.
Impreso:
La impresión directa sobre la bolsa debe ser legible e indeleble.
9.2.19 Resistencia a la tensión en las bolsas.
PROCEDIMIENTO
Realizar esta determinación de acuerdo con el método establecido en la Norma NMX-E-097 (12.11).
INTERPRETACION
La resistencia a la tensión debe ser de 17.02 MPa (175 kgf/cm2) mínima.
9.2.20 Elongación en las bolsas.
PROCEDIMIENTO
Realizar esta determinación de acuerdo con el método establecido en la Norma NMX-E-097 (12.11).
INTERPRETACION
La elongación, en las bolsas debe ser del 200% mínimo.
9.2.21 Pirógenos.
REACTIVOS
Solución de cloruro de sodio al 0.9% m/v, libre de pirógenos.
PREPARACION DE LA MUESTRA
Vaciar la bolsa, lavarla con 250 mL de agua bidestilada inyectable a una temperatura de 292 K a 294 K (19°C a 21°C), desechar los lavados, adicionar a la bolsa 100 mL de la solución de cloruro de sodio, cerrar y calentar en autoclave, manteniendo la temperatura a 383 K (110°C) durante 30 minutos. Proceder como se indica en la FEUM 6a. Ed. MGA 0711, pág. 212, inyectando a cada conejo 10 mL de esta preparación por kilogramo de peso del animal.
INTERPRETACION
Debe ser no pirogénico.
9.2.22 Prueba de seguridad.
PROCEDIMIENTO
Realizar esta determinación de acuerdo con el método establecido en la FEUM 6a. Ed. MGA 0798, Pág. 227.
Elaborar el extracto de acuerdo con el numeral 9.2.5.
INTERPRETACION
Debe cumplir la prueba
9.2.23 Prueba de inyección sistémica.
PROCEDIMIENTO
Realizar esta determinación de acuerdo con el método establecido en la Norma NMX-BB-042.(12.9)
INTERPRETACION
Debe satisfacer la prueba.
9.2.24 Prueba intracutánea.
PROCEDIMIENTO
Realizar esta determinación de acuerdo con el método establecido en la Norma NMX-BB-006-1990 (12.8).
INTERPRETACION
Debe satisfacer la prueba.
9.2.25 Prueba de implantación.
PROCEDIMIENTO
Realizar esta determinación de acuerdo con el método establecido en la Norma NMX-BB-006-1990 (12.8).
INTERPRETACION
Debe satisfacer la prueba.
9.2.26 Metales pesados.
PROCEDIMIENTO
Realizar esta determinación de acuerdo con el método establecido en la FEUM 6a. Ed. MGA 0561, Pág. 187.
Realizar esta determinación en el extracto obtenido en el numeral 9.2.5.
INTERPRETACION
El contenido de metales pesados debe ser para:
Plásticos 1 ppm máximo
Hules 5 ppm máximo
9.2.27 Identificación del material de fabricación y composición química de la aguja.
PROCEDIMIENTO
Realizar esta prueba de acuerdo con el método establecido en la Norma ASTM-E-353 y NMX-BB-001-1988 (12.4).
INTERPRETACION
Los porcentajes obtenidos para los aceros inoxidables deben estar en concordancia con los valores establecidos en las Normas ASTM-E-353 (12.15) y NOM-068-SSA1-1993 (2.2).
9.2.28 Dureza Rockwell-C.
PROCEDIMIENTO
Realizar esta determinación de acuerdo con el método establecido en la Norma NMX-B-119-1983 (12.3).
INTERPRETACION
La dureza de los aceros deben ser de 34 Rockwell-C a 42 Rockwell-C.
9.2.29 Resistencia de la aguja a la corrosión.
PROCEDIMIENTO
Lavar la aguja para punción con jabón neutro y agua a una temperatura de 308 K a 313 K (35°C a 40°C), enjuagar con abundante agua y secar. A continuación hervir en un recipiente con agua durante 30 minutos y dejar reposar durante 24 horas en la misma agua, sacar y secar a temperatura ambiente.
INTERPRETACION
A simple vista no deben tener indicios de corrosión.
9.2.30 Deflexión.
PROCEDIMIENTO
Colocar una aguja horizontalmente sobre el filo de 2 cuchillas separadas 25 mm una de otra, colocar en la parte central una carga de 24.36 N (2.5 kgf).
INTERPRETACION
La deflexión de la aguja no debe ser mayor de 0.30 mm en calibre 16 G y no mayor de 0.45 mm en aguja 15 G.
9.2.31 Aspecto de la solución anticoagulante.
PROCEDIMIENTO
Observar a simple vista la solución anticoagulante.
INTERPRETACION
La solución anticoagulante debe ser transparente y libre de partículas visibles.
9.2.32 Identidad de los componentes.
9.2.32.1 Fosfatos, sodio y citratos.
PROCEDIMIENTO
Realizar esta determinación de acuerdo con la FEUM 6a. Ed. 1994, MGA 0511, utilizando la solución anticoagulante para la identificación de fosfatos y concentrada a la mitad de su volumen para las de sodio y citratos.
INTERPRETACION
La identidad para fosfatos, sodio y citratos debe ser positiva.
9.2.32.2 Dextrosa.
REACTIVO
Solución de prueba de Reactivo de Fehling.
PROCEDIMIENTO
Adicionar unas gotas de una solución 1 en 20 de la muestra a 5 mL de la solución de prueba caliente y observar.
INTERPRETACION
Se debe formar un precipitado copioso de color rojo.
9.2.33 Esterilidad.
PROCEDIMIENTO
Realizar esta determinación de acuerdo con método establecido en la Norma NMX-BB-008-1990 (12.7).
INTERPRETACION
Deben ser estériles.
9.2.34 Cloruros.
PROCEDIMIENTO
Realizar esta determinación de acuerdo con el método establecido en la FEUM 6a. Ed. 1994 MGA 0161 Pág. 95, utilizando 10 mL de la solución anticoagulante como substancia y 0.50 mL de la solución de ácido clorhídrico para la solución patrón.
INTERPRETACION
La solución anticoagulante debe contener máximo un 0.0035% de cloruros.
9.2.35 Valoración de los componentes de la solución anticoagulante.
PROCEDIMIENTO
Realizar esta determinación de acuerdo con el método establecido en la USP XXII, excepto la valoración de citratos, la cual se debe realizar de acuerdo con el método establecido en la USP XXI y adenina que debe ser realizado de acuerdo con la USP XXIII.
INTERPRETACION
El contenido de los componentes de la solución anticoagulante respectiva debe ser del 95% al 105% de lo indicado en la fórmula excepto para adenina en CPDA que será del 90% al 110%.
10. Marcado, empaque y embalaje
10.1 Marcado.
La bolsa debe traer impresos o adheridos en una etiqueta los siguientes datos o leyendas en español, en forma legible e indeleble:
- Nombre del producto.
- Bolsa para recolectar sangre con solución ACD, CPD o CPDA (según proceda).
- Volumen o masa del anticoagulante.
- No permitir la entrada de aire (o leyendas alusivas).
- Desechable (o leyendas alusivas).
- Número de lote y fecha de fabricación (puede estar implícito en el número de lote).
- Número de registro otorgado por la SSA.
- Contenido y superficie interior del producto, estéril y libre de pirógenos (o leyendas alusivas).
- No se use si presenta cualquier signo visible de deterioro (o leyendas alusivas)
- Calibre de la aguja 15 o 16 (según corresponda).
- No se garantiza la esterilidad de este producto en caso de que el mismo tenga señales de haber sufrido ruptura previa (o leyendas alusivas).
- No administrar después de _______ (o leyendas alusivas).
- No utilizar si la solución anticoagulante no está transparente (o leyendas alusivas).
- Donador (o leyendas alusivas) ______________________.
- Fórmula de la solución anticoagulante (cuando no se encuentre en el envase primario).
- Conservar entre 274 K y 279 K (1°C a 6°C).
- Volumen de sangre a recolectar 450 mL o 500 mL (según corresponda).
- Grupo sanguíneo _________________.
- Rh _________________________.
- Hematocrito o Hemoglobina _____________________.
- Hepatitis B_______________, C________________.
- VDRL/RPR __________________.
- VIH (SIDA) ___________________.
- Otras ________________________.
- Fecha de extracción (o leyendas alusivas) ___________________.
- Razón social o nombre y domicilio del fabricante.
- Nombre del banco de sangre (o leyendas alusivas)_____________.
La superficie con los datos o leyendas señalados anteriormente, debe poder marcarse con un bolígrafo común, de manera fácil, clara e indeleble, con toda la información posterior que se requiera.
El tamaño de la etiqueta no debe interferir u obstaculizar la inspección del contenido de la bolsa.
El tubo transportador primario debe tener un mínimo de 10 impresiones indelebles, espaciadas, con un mismo número identificador.
10.2 Empaque.
El empaque o envase del producto debe reunir las especificaciones señaladas en el Reglamento de Insumos para la Salud.
El empaque debe proteger al producto, mantener la esterilidad y resistir las condiciones de manejo, transporte y almacenamiento en los diferentes climas del país.
10.2.1 Empaque primario (cuando exista).
Bolsa de plástico transparente, no pigmentado, de tamaño adecuado para contener un producto estéril.
10.2.2 Empaque múltiple.
Bolsa de aluminio o contenedor de cualquier otro material apropiado, resistente, de tamaño adecuado para contener los empaques primarios o los productos.
10.2.2.1 Leyendas en el empaque múltiple.
El empaque múltiple debe llevar impreso o adherido un marbete con los siguientes datos o leyendas en español, en forma legible e indeleble, de acuerdo con la Ley General de Salud y su Reglamento correspondiente:
- Nombre del producto.
- Número de lote y fecha de fabricación (puede estar implícito en el número de lote).
- Calibre de la aguja 15 o 16 G (según corresponda).
- Marca o logotipo, razón social o nombre y domicilio del fabricante, importador y proveedor.
- Producto estéril. No se garantiza la esterilidad del producto en caso de que el empaque primario haya sufrido ruptura previa (o leyendas alusivas).
- Libre de pirógenos.
- Desechable (o leyendas alusivas).
- Número de registro otorgado por la SSA.
- País de origen.
- Cantidad de bolsas.
- Fecha de caducidad 2 años mínimo al momento de la fabricación (cuando no se garanticen 5 años de esterilidad en el producto).
- Fórmula de la solución anticoagulante.
- Instrucciones de manejo.
10.2.3 Embalaje.
Empaque: Caja de cartón corrugado u otro material que garantice la integridad de los empaques múltiples, con leyendas alusivas a su manejo.
11. Almacenamiento y distribución
Almacenar en locales cubiertos, protegidos de la lluvia y de la exposición directa a los rayos del sol, así como de fuentes de calor o vapores.
12. Bibliografía
12.1 Ley General de Salud. Secretaría de Salud. México, D.F., 1993.
12.2 Reglamento de Insumos para la Salud. México, D.F., 1998.
12.3 NMX-B-119-1983 Industria siderúrgica dureza rockwell y rockwell superficial en productos de hierro y acero - Método de prueba.
12.4 NMX-BB-001-1988 Método de análisis químico para determinar la composición de aceros y fundiciones.
12.5 NMX-BB-035-1972 Método de prueba para la determinación del alargamiento (elongación).
12.6 NMX-BB-092-1989 Industria del plástico. Equipo para uso médico contenido de óxido de etileno residual. Método de prueba.
12.7 NMX-BB-008-1990 Equipo para uso médico, esterilidad. Método de prueba.
12.8 NMX-BB-006-1990 Determinación de toxicidad, pirogenicidad y reacciones tisulares en jeringas de plástico desechables.
12.9 NMX-BB-042-1976 Determinación de toxicidad, pirogenicidad y reacciones tisulares en agujas hipodérmicas desechables.
12.10 NMX-BB-034-1972 Método de prueba para la determinación de la resistencia a la tensión.
12.11 NMX-E-097-1990 Plásticos acondicionamiento, pruebas físicas, químicas a plásticos, látex u otros elastómeros naturales.
12.12 NMX-E-085-1990 Plástico. Tuberías de Cloruro de Polivinilo (PVC), Anillos de Hule usados como sello - Determinación de la dureza Shore "A".
12.13 The United States Pharmacopeia, 22nd. Ed., National Formulary 17th Ed., Mack Publishing Co., Easton Pennsylvania, 1990, pp.99-101, 408 y 1470 - 1472.
12.14 The United States Pharmacopeia, 23th Ed., National Formulary 18th Ed., Mack Publishing Co., Easton Pennsylvania, 1995.
12.15 ASTM-E-353 Chemical Analysis of Stainless Heat Resisting Maraging and Other Similar Chromium-Nickel-Iron-Alloys.
12.16 British Standard 2463; Part 1. Transfusion Equipment for Medical Use. Part 1 Specification for Collapsible Containers for Blood and Blood Components.
12.17 British Pharmacopeia, Her Majesty's Stationery Office, Vol. II, London England, 1988, pp. A65 y A216 - A217.
12.18 The United States Pharmacopeia, 21th Ed., National Formulary 16th Ed., Mack Publishing Co., Easton Pennsylvania, 1995, pp. 68-69.
12.19 NMX-Z-12-1987 Muestreo para la inspección por atributos.
13. Concordancia con normas internacionales y mexicanas
Esta Norma concuerda parcialmente con la Norma British Standar 2463 parte 1.
14. Observancia de la norma
La vigilancia del cumplimiento de la presente Norma corresponde a la Secretaría de Salud, cuyo personal realizará la verificación y la vigilancia que sean necesarias.
15. Vigencia
La presente Norma entrará en vigor con carácter de obligatorio al día siguiente de su publicación en el Diario Oficial de la Federación.
Atentamente
México, D.F., a 19 de octubre de 1998.- El Director General de Insumos para la Salud, Francisco J. Higuera Ramírez.- Rúbrica.
Fecha de Publicación: 30 de octubre de 1998
Si quiere obtener una copia del texto completo, presione aquí ![]()