NORMA Oficial Mexicana NOM-152-SSA1-1996, Que establece las especificaciones sanitarias de los catéteres rígidos para diálisis peritoneal infantil y adulto.
Al margen un sello con el Escudo Nacional, que dice: Estados Unidos Mexicanos.- Secretaría de Salud.
NORMA OFICIAL MEXICANA NOM-152-SSA1-1996, QUE ESTABLECE LAS ESPECIFICACIONES SANITARIAS DE LOS CATETERES RIGIDOS PARA DIALISIS PERITONEAL INFANTIL Y ADULTO.
JAVIER CASTELLANOS COUTIÑO, Presidente del Comité Consultivo Nacional de Normalización de Regulación y Fomento Sanitario, con fundamento en los artículos 39 de la Ley Orgánica de la Administración Pública Federal; 4o. y 69-H de la Ley Federal de Procedimiento Administrativo; 13 apartado A fracción II, 194 fracción II, 195, 201, 210 y demás aplicables de la Ley General de Salud; 3o. fracción XI, 38 fracción II, 40 fracción XI, 41 y 47 de la Ley Federal sobre Metrología y Normalización; 9o., 14, 15 fracción V, 18 y 100 del Reglamento de Insumos para la Salud; 28 y 34 del Reglamento de la Ley Federal sobre Metrología y Normalización, y 6o. fracción XVII y 20 fracción III del Reglamento Interior de la Secretaría de Salud, y
CONSIDERANDO
Que con fecha 19 de octubre de 1998, en cumplimiento de lo previsto en el artículo 46 fracción I de la Ley Federal sobre Metrología y Normalización, la Dirección General de Control de Insumos para la Salud presentó al Comité Consultivo Nacional de Normalización de Regulación y Fomento Sanitario, el anteproyecto de la presente Norma Oficial Mexicana.
Que con fecha 20 de enero de 1999, en cumplimiento del acuerdo del Comité y de lo previsto en el artículo 47 fracción I de la Ley Federal sobre Metrología y Normalización, se publicó en el Diario Oficial de la Federación el proyecto de la presente Norma Oficial Mexicana, a efecto de que dentro de los siguientes noventa días naturales posteriores a dicha publicación, los interesados presentaran sus comentarios al Comité Consultivo Nacional de Normalización de Regulación y Fomento Sanitario.
Las respuestas a los comentarios recibidos por el mencionado Comité, fueron publicadas previamente a la expedición de esta Norma en el Diario Oficial de la Federación, en los términos del artículo 47 fracción III de la Ley Federal sobre Metrología y Normalización.
Que en atención a las anteriores consideraciones, contando con la aprobación del Comité Consultivo Nacional de Normalización de Regulación y Fomento Sanitario, se expide la siguiente:
NORMA OFICIAL MEXICANA NOM-152-SSA1-1996, QUE ESTABLECE QUE LAS ESPECIFICACIONES SANITARIAS DE LOS CATETERES RIGIDOS PARA DIALISIS PERITONEAL INFANTIL Y ADULTO
PREFACIO
En la elaboración de la presente Norma participaron las siguientes Unidades Administrativas e Instituciones:
SECRETARIA DE SALUD
Dirección General de Insumos para la Salud
Dirección General de Calidad Sanitaria de Bienes y Servicios
INSTITUTO POLITECNICO NACIONAL
Escuela Nacional de Ciencias Biológicas
UNIVERSIDAD AUTONOMA METROPOLITANA
UNIVERSIDAD NACIONAL AUTONOMA DE MEXICO
Facultad de Química
CAMARA NACIONAL DE LA INDUSTRIA DE LA TRANSFORMACION
Consejo Paramédico
CAMARA NACIONAL DE LA INDUSTRIA FARMACEUTICA
INSTITUTO MEXICANO DEL SEGURO SOCIAL
Unidad de Control Técnico de Insumos
LABORATORIOS PISA, S.A. DE C.V.
BAXTER, S.A. DE C.V.
LABORATORIOS ALPHA, S.A. DE C.V.
TROKAR, S.A. DE C.V.
INDUSTRIAS PLASTICAS MEDICAS, S.A. DE C.V.
GIFYT, S.A.
EQUIPOS DE BIOMEDICINA, S.A. DE C.V.
INSTRUMED DE MEXICO, S.A. DE C.V.
LK19INDICE
1. Objetivo y campo de aplicación
2. Referencias
3. Definiciones, símbolos y abreviaturas
4. Descripción y clasificación del producto
5. Especificaciones
6. Muestreo
7. Métodos de prueba
8. Marcado, etiquetado, envasado, embalaje y almacenamiento
9. Bibliografía
10. Concordancia con normas internacionales y mexicanas
11. Observancia de la norma
12. Vigencia
13. Apéndice
1. Objetivo y campo de aplicación
1.1 Objetivo
Esta Norma Oficial Mexicana establece las especificaciones que debe cumplir el catéter rígido desechable y señala los métodos de prueba para la verificación de las mismas.
1.2 Campo de aplicación
Esta Norma Oficial Mexicana es de observancia obligatoria en el territorio nacional para todas las industrias, laboratorios y establecimientos dedicados al proceso de este producto, quienes deberán aplicarla en la adquisición, inclusión, inspección de recepción, muestreo y suministro del mismo.
2. Referencias
Para la correcta aplicación de esta Norma es conveniente consultar las siguientes Normas Oficiales Mexicanas:
NOM-068-SSA1-1993 Que Establece las Especificaciones Sanitarias de los Instrumentos Quirúrgicos, Materiales Metálicos de Acero Inoxidable.2.1
2.2 NOM-008-SCFI-1993 Sistema General de Unidades de Medida.
3. Definiciones, símbolos y abreviaturas
3.1 Definiciones
Para efectos de esta Norma se entiende por:
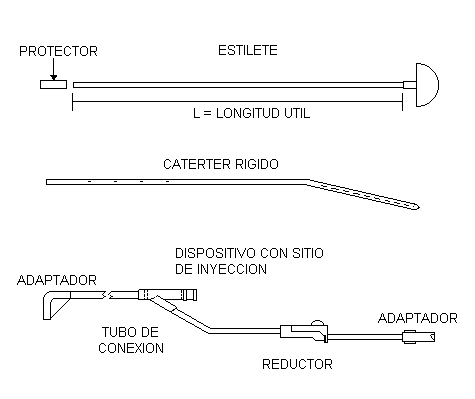
3.1.1 Catéter, al tubo de plástico grado médico, con varios orificios laterales y punta roma, de consistencia rígida que sirve para realizar la diálisis peritoneal.
3.1.2 Diálisis, al cambio que se establece entre dos soluciones con substancias de distinta naturaleza a través de una membrana porosa que las separa.
3.1.3 Estilete, a la porción elaborada en acero inoxidable. El extremo proximal del mismo, debe terminar en punta con filo cortante para lograr su inserción, el extremo distal debe tener un asa, la cual sirve también de tope evitando que la punta del estilete salga demasiado del catéter. Esta asa puede ser continuación del estilete si es del mismo material o estar firmemente integrado al estilete en el caso de que ésta sea de material plástico.
3.1.4 Extremo distal, a la porción del catéter más alejada del paciente.
3.1.5 Extremo proximal, a la porción del catéter más cercana al paciente.
3.1.6 Plástico grado médico, a los polímeros, los cuales son procesados mediante formulaciones específicas que garantizan la atoxicidad del producto.
3.1.7 Protector de la punta del estilete, a la pieza plástica que resguarda el filo de la punta del estilete.
3.1.8 Tubo de conexión, al tubo fabricado de plástico grado médico flexible y translúcido. Su extremo proximal lleva un dispositivo acodado que puede ser parte integral o no del tubo, y en el otro extremo debe estar unido un adaptador. Consta de un dispositivo con sitio de inyección y reductor de flujo.
3.2 Símbolos y Abreviaturas
El significado de los símbolos y abreviaturas utilizados en esta Norma son los siguientes:
|
> |
mayor que |
|
< |
menor que |
|
/m |
sobre |
|
+ |
más menos |
|
- |
a |
|
AISI |
American Iron and Steel Institute |
|
ASTM |
American Standard Testing for Materials |
|
ºC |
grado Celsius |
|
cm |
centímetro |
|
h |
hora |
|
ISO |
International Organization for Standardization |
|
IP |
Intraperitoneal |
|
IV |
Intravenoso |
|
K |
Kelvin |
|
kgf/cm2 |
kilogramo de fuerza por centímetro cuadrado |
|
KPa |
Kilopascales |
|
L |
litro |
|
ml |
mililitro |
|
ml/min |
mililitro por minuto |
|
mm |
milímetro |
|
mmHg |
milímetro de mercurio |
|
MPa |
Megapascales |
|
N |
Newton |
|
NCA |
Nivel de Calidad Aceptable |
|
pH |
concentración de hidrogeniones |
|
ppm |
partes por millón |
|
s |
segundo |
|
SSA |
Secretaría de Salud |
4. Descripción y clasificación del producto
4.1 Catéter para diálisis peritoneal, de plástico rígido, estéril y desechable con orificios laterales, estilete metálico y tubo de conexión, con sitio de inyección de hule. Adulto e Infantil.
4.2 Es la sección tubular, elaborada de material plástico grado médico, translúcido, rígido. El extremo proximal debe tener bordes romos. Hacia ese mismo lado y sobre las paredes del tubo, debe tener de 3 a 4 hileras de perforaciones de forma circular, distribuidas en sentido longitudinal. Debe presentar una curvatura con respecto a la porción del extremo distal. El extremo distal debe tener por lo menos una acotación impresa sobre la superficie externa, la cual debe ser nítida y estar marcada con tinta indeleble de color negra o azul.
4.3 Los materiales usados en la fabricación de catéteres rígidos para diálisis peritoneal infantil y adulto, deben ser de plástico grado médico y la selección de los mismos depende de su diseño, proceso de manufactura y método de esterilización empleado por los fabricantes.
5. Especificaciones
|
DETERMINACION |
ESPECIFICACION |
CONFORME A LO ESTABLECIDO EN ESTA NORMA EN EL NUMERAL: |
|
ACABADO |
El acabado en toda su superficie debe estar libre de fisuras, deformaciones, burbujas, oquedades, rebabas, rugosidades, roturas, delaminaciones, material infusible, material extraño. El tubo de conexión debe ser translúcido, no debe tener piezas desensambladas. El estilete no debe presentar corrosión a simple vista. No deben faltar piezas. |
7.2 |
|
DIMENSIONES Del estilete: Longitud útil (cm)
Longitud libre entre catéter y punta del estilete (cm) Diámetro (cm) Tipo de punta Tipo de filo Del catéter: Longitud total (cm)
Diámetro interior extremo distal (cm) Diámetro interior extremo proximal (cm) Diámetro exterior (cm) Cantidad de hileras con perforaciones Cantidad de perforaciones por hilera
Diámetro de las perforaciones(cm) |
17,0 – 29,0
0,17-0,25 Extrafuerte Cortante
17,0 – 30,0 0,23-0,30
5-16 15-25 0,05 mínimo. |
7.3 |
|
Distancia de la acotación al extremo distal (cm) |
|
|
|
Distancia longitudinal de hileras con perforaciones (cm):
|
3,5 a 6,5 6,0 a 9,7 |
|
|
ESTERILIDAD |
Debe ser estéril. |
7.4 |
|
OXIDO DE ETILENO RESIDUAL (ppm) |
|
7.5 |
|
PIROGENOS |
Debe estar libre de pirógenos. |
7.6 |
|
VELOCIDAD DE FLUJO A TRAVES DEL CATETER |
|
|
|
PLASTICOS Prueba Intracutánea Prueba de Inyección Sistémica Metales Pesados, ppm |
Debe satisfacer la prueba de acuerdo al numeral 7.7. Debe satisfacer la prueba de acuerdo al numeral 7.8. 1 máximo. |
7.7 7.8 7.9 |
|
Límites de Acidez y Alcalinidad |
No debe usarse más de 1 ml de cualquiera de las dos soluciones volumétricas estándar, como indicadores para el cambio al color gris. |
7.10 |
|
HULES Implantación Prueba de Integridad Resistencia de los ensambles |
Debe satisfacer la prueba de acuerdo al numeral 7.11. No debe tener fugas de aire. Los ensambles deben soportar un peso de 1,5 kg al término al término del intervalo de la prueba. |
7.11 7.12
|
|
METALES Composición química Material de fabricación Resistencia a la corrosión
|
Debe satisfacer la prueba de acuerdo al numeral 7.14. Debe satisfacer la prueba de acuerdo al numeral 7.14. A simple vista no debe tener indicios de corrosión sobre su superficie. 80 ± 4º Rockwell-B. |
7.14 7.14
7.16 |
6. Muestreo
6.1 Para efectos de muestreo e inspección se debe aplicar la Norma Mexicana NMX-Z-012-1987 Muestreo para la Inspección por Atributos.
6.2 Clasificación de defectos.
6.2.1 Críticos.
6.2.1.1 Piezas desensambladas o rotas.
6.2.1.2 Falta total de orificios.
6.2.1.3 Piezas faltantes.
6.2.1.4
Ausencia total de datos o leyendas o si está ausente o ilegible alguno de los
siguientes en
envase primario.
6.2.1.4.1 Fecha de fabricación (puede estar implícita en el número de lote).
6.2.1.4.2 Número de lote.
6.2.1.4.3 Marca o logotipo, razón social o nombre y domicilio del fabricante.
6.2.1.4.4 Nombre y domicilio del importador y proveedor.
6.2.1.4.5 Desechable (o leyendas alusivas).
6.2.1.4.6 Atóxico.
6.2.1.4.7 Instrucciones de uso.
6.2.1.4.8 Fecha de caducidad.
6.2.2 Mayores.
6.2.2.1 Envase primario sucio, manchado o deteriorado.
6.2.2.2 No cumplir con otros requisitos de etiquetado indicados en otras disposiciones aplicables.
6.2.2.3 Si está ausente o ilegible alguno de los siguientes datos o leyendas en envase primario.
6.2.2.3.1 Nombre genérico del producto.
6.2.2.3.2 Número de registro otorgado por la SSA.
6.2.2.3.3 Producto estéril y libre de pirógenos.
6.2.2.3.4 No se garantiza la esterilidad del producto en caso de que el envase primario haya sufrido ruptura previa (o leyendas alusivas).
6.2.3 Menores.
6.2.3.1 Si está ilegible o ausente el dato de País de Origen en envase primario.
6.2.3.2
Si está borroso pero legible alguno de los datos o leyendas mencionados en
defectos críticos
o mayores.
6.2.3.3
Si la etiqueta está rota, desgarrada o mojada, pero con información legible y
completa en
envase primario.
6.3 Criterios de aceptación o rechazo.
|
Tabla 1. Criterio de aceptación o rechazo |
|
|
TIPO DE DEFECTO |
NCA |
|
Crítico |
1,5 |
|
Mayor |
2,5 |
|
Menor |
6,5 |
7. Métodos de prueba
7.1 Selección de la muestra
7.1.1 Para el análisis de laboratorio y retención de muestras seleccionar al azar la cantidad de muestra proveniente de un mismo lote.
7.1.2 Los aparatos utilizados deben estar debidamente calibrados.
7.1.3 Todas las pruebas deben realizarse empleando disolventes y reactivos grado reactivo, agua destilada y material de vidrio borosilicato de bajo coeficiente de expansión térmica, a menos que se indiquen otras condiciones.
7.2 Acabado
7.2.1 Procedimiento
Inspeccionar a simple vista el producto.
7.2.2 Interpretación
El acabado en toda su superficie debe estar libre de fisuras, deformaciones, burbujas, oquedades, rebabas, rugosidades, roturas, delaminaciones, material infusible, material extraño. El tubo de conexión debe ser translúcido. El estilete no debe presentar corrosión a simple vista. No debe tener piezas desensambladas. No deben faltar piezas.
7.3 Dimensiones
7.3.1 Procedimiento
Utilizar una regla metálica para medir longitudes y un comparador óptico con una exactitud de 0,001 mm o Vernier con una exactitud de 0,01 mm, para medir diámetros.
7.3.2 Interpretación
Debe cumplir con las dimensiones indicadas en el apartado 5 de esta Norma.
7.4 Esterilidad
7.4.1 Procedimiento
Realizar esta prueba de acuerdo a lo establecido en la Norma Mexicana NMX-BB-008-1990 Equipo para uso Médico-Esterilidad-Método de Prueba.
7.4.2 Interpretación
La muestra debe ser estéril.
7.5 Oxido de etileno residual
7.5.1 Procedimiento
Realizar esta prueba de acuerdo con el método establecido en la Norma Mexicana NMX-BB-092-1989 Equipo para Uso Médico-Contenido de Oxido de Etileno Residual-Método de Prueba.
7.5.2 Interpretación
La muestra no debe contener más de 25 ppm de óxido de etileno.
7.6 Prueba de pirógenos
7.6.1 Procedimiento
Realizar esta prueba de acuerdo con el método establecido en la Norma NMX-BB-006-1990 Equipo para uso Médico-Toxicidades, Pirogenicidades y Reacciones Tisulares en Jeringas, Agujas y otros Equipos Similares-Métodos de Prueba.
7.6.2 Interpretación
La muestra debe estar libre de pirógenos.
7.7. Prueba intracutánea
7.7.1 Fundamento
El método se basa en la evaluación del promedio de reacciones obtenido en la piel de los conejos con respecto al promedio de reacción del blanco.
7.7.2 Espécimen de prueba
Seleccionar conejos blancos sanos, que no hayan sido utilizados en ninguna prueba de piel delgada, que pueda rasurarse con facilidad y que esté libre de irritación o trauma mecánico.
7.7.3 Reactivos, materiales y equipo
7.7.3.1 Reactivos:
7.7.3.1.1 Alcohol
7.7.3.1.2 Agua inyectable
7.7.3.1.3 Aceite vegetal
7.7.3.1.4 Polietilenglicol 400
7.7.3.1.5 Solución de cloruro de sodio al 0,9%
7.7.3.2 Materiales:
7.7.3.2.1 Recipientes de extracción*
7.7.3.2.2 Tijeras de acero inoxidable
7.7.3.2.3 Agujas hipodérmicas calibre 15 G X 19,0 mm
7.7.3.2.4 Mandril o estilete
7.7.3.2.5 Agujas calibre 26 G con longitud de 19,1 o 25,4 mm (3/4 pulgada o 1 pulgada)
7.7.3.2.6 Jeringas
7.7.3.2.7 Rasuradora
*Utilizar recipientes como: Ampulas o tubo de ensayo para cultivo de vidrio tipo "I", con tapón de rosca, con un forro elastomérico adecuado, el cual debe estar completamente protegido con un disco sólido inerte de 50 a 75 mm de espesor y que pueda fabricarse con una resina de politetrafluoretileno.
7.7.3.3 Equipo
7.7.3.3.1 Horno de preferencia de circulación forzada, con un intervalo de operación de 323 K a 343 K (50ºC a 70ºC).
7.7.4 Preparación de la muestra
7.7.4.1 Seleccionar y subdividir la muestra en porciones, como las que se indican en la siguiente tabla:
|
Tabla No. 2.- Superficie de la muestra a aprobar |
|||
|
Forma de plástico |
Espesor |
Cantidad de muestra por
cada |
Subdivisiones |
|
Película u hoja |
< 0,5 mm
0,5 a 1 mm |
De 120 cm2 de superficie total (ambos lados) De 60 cm2 de superficie total (ambos lados) |
Tiras de aproximadamente 5 X 0,3 cm. Tiras de aproximadamente 5 X 0,3 cm. |
|
Tubos |
< 0,5 mm (pared)
|
Longitud (en cm) = 120 cm2 / suma del diámetro interno y externo Longitud (en cm) = 60 cm2 / suma del diámetro interno y externo |
Secciones de aproximadamente 5 X 0,3 cm. Secciones de aproximadamente 5 X 0,3 cm. |
|
Planos, tubulares y moldeados |
> 1 mm |
Equivalente a 60 cm2 de la superficie total (todas las superficies expuestas) |
Piezas de aproximadamente 5 X 0,3 cm. |
7.7.4.2 Retirar las partículas sueltas de la muestra como sigue:
7.7.4.2.1 Colocar las muestras subdivididas en una probeta graduada de vidrio de 100 ml y añadir aproximadamente 70 ml de agua inyectable. Agitar aproximadamente por 30 segundos y decantar, repetir este paso, secar aquellas piezas preparadas para la extracción con aceite vegetal en un horno a una temperatura que no exceda 323 K (50ºC).
Nota: No limpiar el plástico con tela, ni lavar o enjuagar con disolventes orgánicos o detergentes.
7.7.4.3 Colocar una muestra de plástico, preparada adecuadamente en un recipiente de extracción. Añadir 20 ml de medio de extracción apropiado de acuerdo a la siguiente tabla:
|
Tabla No. 3.- Medios de extracción utilizados para cada plástico |
|||
|
Clase de plástico |
Medio de extracción |
||
|
IV |
V |
VI |
|
|
X |
X |
X |
Solución de cloruro de
sodio al |
|
X |
X |
X |
Solución de alcohol 1 en 20 en solución de cloruro de sodio al 0,9 % |
|
- |
X |
X |
Polietilenglicol 400 |
|
X |
- |
X |
Aceite vegetal (sésamo o de semilla de algodón) |
7.7.4.4 Extraer en autoclave a 394 K (121ºC) durante 60 minutos, en horno a 343 K (70ºC) por 24 horas a 323 K (50ºC) durante 72 horas. Dejar el tiempo necesario para que el líquido dentro del recipiente alcance la temperatura de extracción.
7.7.4.5 Las condiciones de extracción no deben en ninguna instancia producir cambios físicos tales como fusión o licuefacción de las piezas de plástico ya que estos cambios provocan una disminución de área superficial. Puede tolerarse una ligera adherencia entre las piezas.
7.7.4.6 Si se utilizan tubos de cultivo para extracciones con aceite vegetal en autoclave, sellar los tapones de la rosca con una cinta testigo para esterilizar.
7.7.4.7 Dejar enfriar los recipientes a una temperatura no menor de 295 K (22ºC) agitar vigorosamente durante varios minutos y decantar cada extracto inmediatamente en forma aséptica dentro de un vaso de precipitado seco y estéril. Almacenar los extractos a una temperatura entre 295 K y 303 K (22ºC y 30ºC) y no utilizarlos para pruebas después de 24 horas.
7.7.5 Preparación del blanco
Colocar individualmente en un recipiente de extracción 20 ml de polietilenglicol 400 como medio de extracción de acuerdo a lo indicado en la tabla siguiente:
|
Tabla No. 4.- Dosis y
vías de administración del blanco, muestra problema y medios |
|||||
|
No. de grupo |
Extracto: E Blanco: B |
Medio de extracción |
Dosis por kg |
Vía de administración |
Velocidad de inyección ml/s |
|
5 6 |
E B |
Polietilenglicol 400 |
10 g |
IP |
---- |
7.7.6 Procedimiento
El día de la prueba rasurar completamente la piel del lomo del animal, hacia ambos lados de la columna vertebral, sobre un área de prueba suficientemente larga. Evitar la irritación o el trauma mecánico. Retirar el pelo suelto por medio de limpieza por aspiración.
Si es necesario, limpiar la piel suavemente con alcohol diluido y secarla antes de inyectar. Antes de llenar la jeringa con las dosis de inyección agitar cada extracto vigorosamente para asegurar la distribución completa de la materia extraída.
Diluir cada gramo del extracto de la muestra preparado con polietilenglicol 400 y su blanco correspondiente con 7,4 volúmenes de solución de cloruro de sodio al 0,9% para obtener una solución que contenga una concentración de aproximadamente 120 mg de polietilenglicol 400 por mililitro.
Inyectar intracutáneamente 0,2 ml de cada extracto de muestra, en 10 sitios sobre uno de los lados de cada uno de estos conejos. En forma semejante inyectar 0,2 ml de blanco correspondiente en 5 sitios del otro lado de cada conejo.
Examinar los sitios de inyección a las 24, 48 y 72 horas después de la inyección para detectar evidencia de reacción tisular como eritema, edema y escaras. Para facilitar el examen, tratar la piel suavemente con alcohol diluido y rasurar la piel si es necesario.
Valorar las observaciones sobre una escala numérica para el extracto de la muestra y el blanco, respectivamente, de acuerdo a la siguiente tabla:
|
Tabla No. 5 Evaluación de las reacciones de la piel |
|
|
Eritema y formación de escaras |
Valor |
|
Eritema ausente |
0 |
|
Eritema ligero (escasamente perceptible) |
1 |
|
Eritema bien definido |
2 |
|
Eritema de moderado a severo |
3 |
|
Eritema severo (enrojecimiento intenso) a formación ligera de escaras (daño intenso) |
4 |
|
Formación de edema |
Valor |
|
Edema ausente |
0 |
|
Edema muy ligero (escasamente perceptible) |
1 |
|
Edema ligero (bordes del área bien definidos por inflamación) |
2 |
|
Edema moderado (inflamación aproximadamente de 1 mm) |
3 |
|
Edema severo (inflamación mayor a 1 mm que se extiende más allá del área de exposición) |
4 |
7.7.7 Interpretación
La muestra cumple con las especificaciones de la prueba si el promedio de reacciones de la muestra no es significativamente mayor que el promedio de reacciones del blanco.
Si el resultado es dudoso repetir la prueba en tres conejos más con extractos preparados recientemente.
Las especificaciones de la prueba se cumplen, si en la prueba de repetición el promedio de reacción para el extracto de la muestra, no es significativamente mayor que el promedio de reacción para el blanco (9.5 a).
7.8 Prueba de inyección sistémica
7.8.1 Fundamento
El método se basa en la observación entre las reacciones que se presenten entre los ratones tratados con los extractos y los ratones tratados con el blanco.
7.8.2 Espécimen de prueba
Utilizar ratones blancos, sanos que no hayan sido utilizados previamente con un peso entre 17 y 23 g de una misma cepa y ofrecer a satisfacción agua y alimento para animales de laboratorio de composición conocida.
7.8.3 Reactivos, materiales y equipos
Debe cumplir con lo especificado en el subnumeral 7.7.3 de esta Norma.
7.8.4 Preparación de la muestra
Debe cumplir con lo especificado en el subnumeral 7.7.4 de esta Norma.
7.8.5 Preparación del blanco
Debe cumplir con lo establecido en el subnumeral 7.7.5 de esta Norma.
7.8.6 Procedimiento
Seleccionar 40 ratones y separarlos en 8 grupos de 5 ratones cada uno. Pesar y marcar cada uno de los animales de cada grupo de prueba. Agitar cada extracto vigorosamente antes de separar cada dosis de inyección para asegurar la completa distribución de la materia extraída. Inyectar cada uno de los animales con los extractos de muestra y blanco por la vía de administración y dosis que corresponda al peso del animal de acuerdo a la tabla siguiente, excepto el extracto obtenido con polietilenglicol 400 y su blanco correspondiente que deben diluirse con 4,1 volúmenes de solución de cloruro de sodio al 0,9% para obtener una solución con una concentración de aproximadamente 200 mg de polietilenglicol por ml.
|
Tabla 6. Dosis y vía de administración del blanco, muestra problema y medios de extracción utilizados |
|||||
|
No. de grupo |
Extracto: E Blanco: B |
Medio de extracción |
Dosis por kg |
Vía de administración |
Velocidad de inyección ml/seg |
|
1 2 |
E B |
Solución de cloruro de sodio al 0,9 %. |
50ml |
IV |
0,1 |
|
3 4 |
E B |
Solución de alcohol 1 en 20 en solución de cloruro de sodio al 0,9 %. |
50ml |
IV |
0,1 |
|
5 6 |
E B |
Polietilenglicol 400 |
10 g |
IP |
---- |
|
7 8 |
E B |
Aceite vegetal (sésamo o de semilla de algodón). |
50ml |
IP |
---- |
Observar los animales inmediatamente después de la inyección y a las 4, 24, 48 y 72 horas posteriores.
7.8.7 Interpretación
Si durante su periodo de observación ninguno de los animales tratados con los extractos de la muestra presenta una reacción significativamente mayor que los animales tratados con el blanco, la muestra cumple con las especificaciones de la prueba.
Si alguno de los animales tratados con la muestra presenta ligeros síntomas de toxicidad y no más de uno de los animales muestra síntomas severos de toxicidad o muere, repita la prueba utilizando grupos de diez ratones cada uno. En la prueba de repetición las especificaciones de la prueba se cumplen si ninguno de los animales tratados con la muestra presenta una reacción significativamente mayor que la observada en los animales tratados con el blanco (9.5 b).
7.9 Metales pesados
7.9.1 Procedimiento
Realizar esta prueba de acuerdo con el método MGA 0561 de la Farmacopea de los Estados Unidos Mexicanos.
7.9.2 Interpretación
La muestra no debe contener más de 1 ppm de metales pesados.
7.10 Límites de acidez y alcalinidad (pH).
7.10.1 Preparación de las soluciones de trabajo.
7.10.1.1 Preparación de la muestra
Utilizar una porción rectangular de la muestra en cantidad suficiente para cubrir las necesidades de extracto en cuanto a las pruebas fisicoquímicas descritas y de acuerdo a lo especificado en el párrafo siguiente. Subdividir en tiras de aproximadamente 3,0 mm de ancho y 5,0 mm de largo, introducirlas en una probeta graduada de vidrio tipo "I" de 250 ml con tapón esmerilado; agregar 150 ml de agua purificada, agitar las muestras durante 30 segundos, desechar el líquido y repetir la operación. Pasar la muestra al recipiente de extracción, y agregar la cantidad de agua purificada necesaria, calculada en base a emplear 20 ml del medio de extracción por cada 60 cm2 del material. Para el cálculo de superficie del material deben considerarse el largo y ancho de una cara del rectángulo.
Extraer por calentamiento en baño maría durante 24 horas a 343 K (70ºC). Enfriar a una temperatura no mayor de 295 K (22ºC) y decantar el líquido de extracción a un recipiente limpio y seco; mantener herméticamente cerrado (9.4).
7.10.1.2 Extracto (S1)
Hacer un sistema de circulación cerrado con tres muestras estériles en un matraz kitasato de 500 ml hervido, un tramo de tubería de elastómero de silicón y una bomba peristáltica. Colocar el matraz en un baño María a una temperatura de 310 K + 1 K (37ºC + 1ºC), determinada con un termómetro con una exactitud de 1 K (0,1ºC). Circular 250 ml de agua purificada para inyecciones a través del sistema durante 2 horas a una velocidad de 1 L/h, accionando la bomba peristáltica; conectar toda la solución en un vaso de precipitados de 300 ml y permitir su enfriamiento.
7.10.2 Procedimiento
Para la titulación de la acidez o alcalinidad, debe usarse el extracto (S1).
Añadir 0,1 ml de solución de indicador Tashiro a 20 ml de la solución extracto (S1) en un matraz para titulación. Si el color de la solución resultante es violeta titular con una solución volumétrica estándar de hidróxido de sodio (NaOH) 0,01 molar; y si es verde con una solución de ácido clorhídrico (HCl) 0,01 molar, hasta que el color gris aparezca.
7.10.3 Interpretación de resultados
No debe usarse más de 1 ml de cualquiera de las dos soluciones volumétricas estándar, como indicadores para el cambio a color gris.
7.11 Implantación
7.11.1 Procedimiento
Realizar esta prueba de acuerdo con el método establecido en la NMX-BB-006-1990 Equipo para uso Médico-Toxicidades, Pirogenicidades y Reacciones Tisulares en Jeringas, Agujas y otros equipos Similares-Métodos de Prueba.
7.11.2 Interpretación
Debe satisfacer la prueba.
7.12 Prueba de integridad
7.12.1 Procedimiento
Sumergir el equipo, con el extremo proximal obturado (cubriendo todas las perforaciones), en un tanque con agua a una temperatura de 293 K a 303 K (20ºC a 30ºC). Aplicar por el extremo abierto del equipo, aire a una presión de 50 KPa (0,51 kgf/cm2), arriba de la presión atmosférica, durante 2 minutos y observar el equipo.
7.12.2 Interpretación
No debe tener fugas de aire.
7.13 Resistencia de los ensambles
7.13.1 Procedimiento
Aplicar un peso muerto de 1,5 kg, temperatura 293 K a 300 K (20ºC a 30ºC), tiempo empleado en la aplicación de la fuerza 15 segundos.
7.13.2 Interpretación
Los ensambles deben soportar un peso de 1,5 kg al término del intervalo de la prueba.
7.14 Composición química y material de fabricación del estilete
7.14.1 Procedimiento
Realizar esta prueba de acuerdo con el método establecido en la NOM-068-SSA1-1993 Que Establece las Especificaciones Sanitarias de los Instrumentos Quirúrgicos, Materiales Metálicos de Acero Inoxidable.
7.14.2 Interpretación
Los valores obtenidos para aceros inoxidables deben estar en concordancia con los valores establecidos en la siguiente tabla:
|
Tabla No. 7.- Aceros Austenísticos |
|
|
ISO |
AISI |
|
11 |
304 |
|
20 |
316 |
|
12 |
302 |
7.15 Resistencia a la corrosión para aceros inoxidables
7.15.1 Procedimiento
Lavar el estilete con jabón neutro y agua a temperatura de 308 K a 313 K (35ºC a 40ºC). Posteriormente enjuagar con abundante agua a temperatura ambiente y secar. Hervir en un recipiente de vidrio con agua destilada, durante 30 minutos, dejar sumergidas las piezas durante 24 horas en la misma solución. Transcurrido este tiempo sacar y secar a temperatura ambiente para su inspección.
7.15.2 Interpretación.
A simple vista no debe tener indicios de corrosión sobre su superficie.
7.16 Dureza
7.16.1 Procedimiento
Realizar esta prueba de acuerdo con el método establecido en la NMX-B-119-1993 Industria Siderúrgica-Dureza Rockwell y Rockwell Superficial Productos de Hierro y Acero-Método de Prueba.
7.16.2 Interpretación
La dureza de los aceros debe ser de 80° ± 4º Rockwell-B.
7.17 Velocidad de flujo a través del catéter
7.17.1 Fundamento
El método se basa en la verificación de la velocidad de flujo de agua que pasa a través de cada lumen del catéter, en relación al valor establecido por el fabricante, para cada lumen del catéter.
7.17.2 Procedimiento
Preparar un recipiente de nivel constante, adaptado con un tubo de salida y un adaptador cónico Luer (que cumpla con los requerimientos establecidos en la ISO 594-1), capaz de proporcionar un flujo no menor de 500 ml/min, determinado mediante una probeta graduada con una exactitud de + 1%, y que tenga una columna hidrostática de una altura de 1 000 mm + 5 mm (ver figura 2).
Llenar el recipiente a un nivel constante con agua destilada o desionizada a temperatura de 296 K + 2 K (23° + 2°C). Ensamblar el adaptador del lumen que va a ser evaluado al adaptador macho del recipiente; hacer pasar el flujo de agua a través del lumen del catéter y colectar el flujo por un periodo no menor de 30 segundos en un recipiente adecuado. Determinar su volumen por medio de una probeta graduada o por peso asumiendo que la densidad del agua es equivalente a 1 000 kg/m3. Efectuar tres determinaciones por cada lumen del catéter y calcular el promedio aritmético de las tres determinaciones y expresar éste como la velocidad de flujo de agua a través del catéter en milímetros por minuto y redondear el promedio aritmético al valor más cercano de números enteros en milímetros (9.13).
7.17.3 Interpretación
Para catéteres con un diámetro extremo nominal menor de 1,0 mm, el valor resultante en ml/min, debe estar dentro de un intervalo de 80 a 125% del valor establecido por el fabricante.
Para catéteres con un diámetro externo nominal de 1,0 mm o mayor, el valor resultante en ml/min, debe estar dentro de un intervalo de 90 a 115% del valor establecido por el fabricante.
8. Marcado, etiquetado, envasado, embalaje y almacenamiento
8.1 Marcado y etiquetado
El empaque primario debe tener impresos, adheridos o adicionados los siguientes datos o leyendas en español, en forma legible e indeleble, además de lo indicado por el Reglamento de Insumos para la Salud.
8.1.1 Nombre del producto.
8.1.1.1 Número de lote.
8.1.1.2 Marca o logotipo, razón social o nombre y domicilio del fabricante.
8.1.1.3 Nombre y domicilio del importador y proveedor.
8.1.1.4 Producto estéril y libre de pirógenos.
8.1.1.5 No se garantiza la esterilidad del producto en caso de que el empaque primario haya sufrido ruptura previa (o leyendas alusivas).
8.1.1.6 Atóxico.
8.1.1.7 Desechable (o leyendas alusivas).
8.1.1.8 Fecha de caducidad.
8.1.1.9 Fecha de fabricación, puede estar implícita en el número de lote.
8.1.1.10 Número de registro otorgado por la SSA.
8.1.1.11 País de origen.
8.1.1.12 Instrucciones de uso.
8.1.1.13 Instrucciones de conservación.
8.2 Envasado
El producto debe ser empacado individualmente en envases que preserven su esterilidad y le den protección física en la manipulación normal. El envase debe ser transparente al menos en una de sus caras.
8.3 Embalaje
El empaque o envase del producto debe cumplir lo especificado por el Reglamento de Insumos para la Salud.
El tipo y la calidad del empaque son responsabilidad del proveedor. Debe proteger al producto, mantener la esterilidad y resistir las condiciones de manejo, transporte y almacenamiento en los diferentes climas del país.
8.4 Almacenamiento
Almacenar en locales cubiertos, protegidos de la lluvia y de la exposición directa a los rayos del sol, así como de fuentes de calor o vapores y del polvo.
9. Bibliografía
9.1 Ley General de Salud. 1984.
9.2 Reglamento de Insumos para la Salud D.O.F. 4 de febrero de 1998.
9.3 ASTM-E-353 Methods for Chemical Analysis of Stainless Heat Resisting Marging and Other Similar Chromium Niquel Iron Alloys.
9.4 Farmacopea de los Estados Unidos Mexicanos, Sexta Edición 1994.
9.5 The United States Pharmacopeia Convention, INC 23nd, NF 18, 12601 Twinbrook Parway, Rockville, MD 20852, 1995.
a) BRT (88) Intracutaneous Test pp. 1701, 1702.
b) BRT (88) Systemic Inyection Test p.1701.
9.6 NMX-B-119-1993 Industria Siderúrgica-Dureza Rockwell y Rockwell Superficial Productos de Hierro y Acero-Método de Prueba.
9.7 NMX-BB-006-1990 Equipo para uso Médico-Toxicidades, Pirogenicidades y Reacciones Tisulares en Jeringas, Agujas y otros equipos Similares-Métodos de Prueba.
9.8 NMX-BB-008-1990 Equipo para uso Médico-Esterilidad-Método de Prueba.
9.9 NMX-BB-092-1989 Industria del Plástico-Equipo para uso Médico-Contenido de Oxido de Etileno Residual-Método de Prueba.
9.10 NMX-EE-059-1979 Envases y Embalaje-Símbolos para Manejo, Transporte y Almacenamiento.
9.11 NMX-EE-075-1980 Envase y Embalaje-Papel y Cartón-Determinación de Resistencia al Reventamiento.
9.12 NMX-Z-012-1987 Muestreo para la Inspección por Atributos.
9.13 ISO-10555-3 Sterile, Single-use Intravascular Catheters Part 3 Central venous catheters.
9.14 ISO-8536-4 Infusion Equipment for Medical Use, Part 4 Infusion Sets for Single Use.
10. Concordancia con normas internacionales y mexicanas
Esta norma no es equivalente a ninguna norma internacional o mexicana.
11. Observancia de la norma
La vigilancia del cumplimiento de la presente Norma corresponde a la Secretaría de Salud, cuyo personal realizará la verificación y la vigilancia que sean necesarias.
12. Vigencia
La presente Norma entrará en vigor con carácter obligatorio al día siguiente de su publicación en el Diario Oficial de la Federación.
Atentamente
México, D.F., a 23 de agosto de 2000.- El Subsecretario de Regulación y Fomento Sanitario, Javier Castellanos Coutiño.- Rúbrica.
APENDICE NORMATIVO "A"

FIGURA 1. CATETER RIGIDO PARA DIALISIS PERITONEAL INFANTIL Y ADULTO (NO IMPLICA DISEÑO)
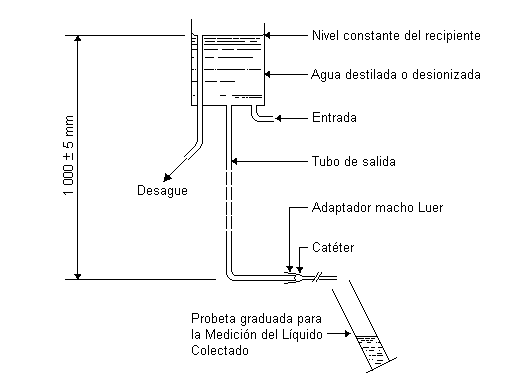
FIGURA 2. EJEMPLO DEL APARATO PARA
LA DETERMINACION DE LA VELOCIDAD DE FLUJO DE AGUA
A TRAVES DEL CATETER
_____________________________________
Fecha de publicación: 3 de octubre de 2000