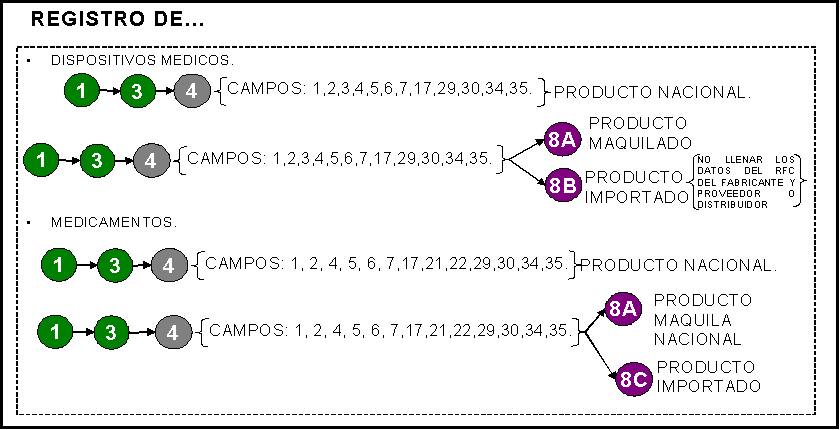ACUERDO por el
que se modifica el diverso por el que se dan a conocer los trámites inscritos
en el Registro Federal de Trámites Empresariales que aplica la Secretaría de
Salud y se establecen diversas medidas de mejora regulatoria
y su anexo único, publicado el 14 de septiembre de 1998, y por el que se dan a
conocer los formatos para la realización de trámites que aplica la Secretaría
de Salud, a través de la Comisión Federal para la Protección Contra Riesgos
Sanitarios.
Al margen
un sello con el Escudo Nacional, que dice: Estados Unidos Mexicanos.-
Secretaría de Salud.
ACUERDO POR EL QUE SE MODIFICA EL DIVERSO
POR EL QUE SE DAN A CONOCER LOS TRAMITES INSCRITOS EN EL REGISTRO FEDERAL DE
TRAMITES EMPRESARIALES QUE APLICA LA SECRETARIA DE SALUD Y SE ESTABLECEN
DIVERSAS MEDIDAS DE MEJORA REGULATORIA Y SU ANEXO UNICO, PUBLICADO EN EL DIARIO OFICIAL DE LA FEDERACION EL 14
DE SEPTIEMBRE DE 1998, Y POR EL QUE SE DAN A CONOCER LOS FORMATOS PARA LA
REALIZACION DE TRAMITES QUE APLICA LA SECRETARIA DE SALUD, A TRAVES DE LA
COMISION FEDERAL PARA LA PROTECCION CONTRA RIESGOS SANITARIOS.
JULIO JOSE FRENK MORA, Secretario de Salud, con fundamento en los artículos 39
fracciones XII, XIII, XIV, XV, XX, XXI y XXIV de la Ley Orgánica de la Administración
Pública Federal; 3, fracción XXII, 17 bis, 194, 283 y 289 de la Ley General de
Salud, 69-M y 69-Q de la Ley Federal de Procedimiento Administrativo; y 1o.,
2o., 3o., 6o. y 7o. fracciones XVI y XVIII del Reglamento Interior de la
Secretaría de Salud; y
CONSIDERANDO
Que el Plan Nacional de Desarrollo 2001-2006 prevé consolidar e
impulsar el marco institucional y la mejora regulatoria
a fin de simplificar la carga administrativa de las empresas, orientando dichos
instrumentos a hacer más eficiente la regulación vigente y a eliminar la
discrecionalidad innecesaria de la autoridad y el exceso de trámites y sus
correspondientes formatos;
Que la Ley Federal de Procedimiento Administrativo establece las
bases para llevar a cabo la mejora regulatoria
sistemática de los trámites que aplica la Administración Pública Federal;
Que la Ley Federal de Procedimiento Administrativo dispone que la
dependencia u organismo descentralizado correspondiente no podrá exigir
trámites y formatos adicionales ni aplicarlos en forma distinta a como se
establecen en el Registro Federal de Trámites y Servicios, salvo por las
excepciones previstas por la propia ley;
Que el artículo 152 del Reglamento de Insumos para la Salud
dispone que en el exportador que decida reingresar al país sus insumos o
productos terminados deberá solicitar permiso de importación; y que los
artículos 234 y 238 del Reglamento del Control Sanitario de Productos y
Servicios establecen que la Secretaría de Salud podrá otorgar permiso de
importación de los productos que regula cuando el solicitante demuestre que son
para donación, consumo personal, para fines de investigación científica o
pruebas de laboratorio; y que cuando se pretenda retornar al país uno de esos
productos, el interesado deberá solicitar permiso previo de importación,
respectivamente;
Que el Acuerdo por el que se dan a conocer los trámites inscritos
en el Registro Federal de Trámites Empresariales que aplica la Secretaría de
Salud y se establecen diversas medidas de mejora regulatoria
y su Anexo Unico, publicado en el Diario Oficial de la Federación el 14
de septiembre de 1998, define de manera específica los requisitos para realizar
los trámites que contempla, sin embargo, no especifica los aplicables para los
permisos de importación en su modalidad de retorno y en los casos en que las
muestras de los productos que se destinen para donación, consumo personal, para
fines de investigación científica o pruebas de laboratorio, siendo necesario
incluirlos a fin de brindar seguridad jurídica al particular;
Que a fin de que el usuario obtenga el permiso de importación para
productos o materia prima que sean o contengan estupefacientes o psicotrópicos
y debido a la naturaleza de los mismos, se consideró necesario solicitarle los
datos del facturador pues en ninguna disposición
aplicable se establece este requisito y en múltiples ocasiones este trámite de
importación se ve afectado por no coincidir los datos del permiso con la
documentación que presenta el importador en la aduana;
Que mediante la disminución de los tiempos de servicio a los
usuarios, la agilidad de los procesos de gestión, la facilidad en la apertura y
operación de las empresas, la reducción de los costos a los particulares al
disminuir el legajo documental y los tiempos de gestión, la eliminación de
duplicidades en las tareas y el aumento en la velocidad de respuesta por parte
de la autoridad, entre otros, la Secretaría logrará la simplificación
administrativa en la realización de trámites y consolidará así la gestión de
procesos;
Que derivado del avance en los procesos de mejora regulatoria y simplificación administrativa implementados
en la Comisión Federal para la Protección contra Riesgos Sanitarios, se
determinó que los diversos formatos para realizar los trámites que contempla el
Acuerdo por el que se dan a conocer los trámites inscritos en el Registro
Federal de Trámites Empresariales que aplica la Secretaría de Salud y se
establecen diversas medidas de mejora regulatoria y
su Anexo Unico, publicado en el Diario Oficial de la Federación el 14 de septiembre de 1998, a la
fecha resultan obsoletos, excesivos e imprecisos por lo que dificultan el
proceso de atención y desahogo de los servicios que presta la Comisión Federal
para la Protección contra Riesgos Sanitarios como órgano desconcentrado de la
Secretaría de Salud;
Que los trámites, cuyos formatos se dan a conocer en el Anexo Unico del presente Acuerdo no podrán ser aplicados en forma
distinta, de conformidad con la propia Ley Federal de Procedimiento
Administrativo;
Que la información contenida en los formatos del Anexo Unico del presente Acuerdo, es la que debe proporcionar la
Comisión Federal para la Protección Contra Riesgos Sanitarios a la Comisión
Federal de Mejora Regulatoria para su modificación en
el Registro Federal de Trámites y Servicios, de conformidad con el artículo
69-M de la Ley Federal de Procedimiento Administrativo; he tenido a bien
expedir el siguiente:
ACUERDO POR EL QUE SE MODIFICA EL DIVERSO POR EL QUE SE DAN A CONOCER
LOS TRAMITES INSCRITOS EN EL REGISTRO FEDERAL DE TRAMITES EMPRESARIALES QUE
APLICA LA SECRETARIA DE SALUD Y SE ESTABLECEN DIVERSAS MEDIDAS DE MEJORA
REGULATORIA Y SU ANEXO UNICO, PUBLICADO EN EL DIARIO OFICIAL DE LA FEDERACION
EL 14 DE SEPTIEMBRE DE 1998, Y POR EL QUE SE DAN A CONOCER LOS FORMATOS PARA LA
REALIZACION DE TRAMITES QUE APLICA LA SECRETARIA DE SALUD, A TRAVES DE LA
COMISION FEDERAL PARA LA PROTECCION CONTRA RIESGOS SANITARIOS
ARTICULO PRIMERO.- Se modifica el Anexo Unico del Acuerdo
por el que se dan a conocer los trámites inscritos en el Registro Federal de
Trámites Empresariales que aplica la Secretaría de Salud y se establecen
diversas medidas de mejora regulatoria y su Anexo Unico, publicado en el Diario
Oficial de la Federación el 14 de septiembre de 1998, en su parte relativa
al trámite de Permiso Sanitario Previo de Importación de Insumos para la Salud,
para establecer que tratándose de retorno de insumos para la salud, se requiere
presentar los siguientes documentos anexos a la solicitud:
1. Copia del pedimento de
exportación.
2. Factura de exportación que
ampare el producto que se exportó, donde se especifique la cantidad, el nombre
y domicilio completo del destinatario.
3. Carta de rechazo emitida
por la autoridad sanitaria del país al que se exportó, donde se indique el
motivo del rechazo; en caso de no ser el rechazo por la autoridad un escrito en
hoja membretada de la empresa donde se indique el
motivo del retorno.
4. Carta del importador donde
indique cantidad, destino y uso del producto, lote y fecha de caducidad en su
caso, en papel membretado de la empresa.
ARTICULO SEGUNDO.- Se modifica el Anexo Unico del Acuerdo
por el que se dan a conocer los trámites inscritos en el Registro Federal de
Trámites Empresariales que aplica la Secretaría de Salud y se establecen
diversas medidas de mejora regulatoria y su Anexo Unico, publicado en el Diario
Oficial de la Federación el 14 de septiembre de 1998, en su parte relativa
al trámite de Permiso Sanitario de Importación de Productos y Servicios, para
establecer que tratándose de retorno de alimentos, suplementos alimenticios,
bebidas alcohólicas, bebidas no alcohólicas, tabaco, productos de aseo,
perfumería y belleza, se requiere presentar los siguientes documentos anexos a
la solicitud:
1. Copia del pedimento de
exportación.
2. Factura de exportación que
ampare el producto que se exportó, donde se especifique la cantidad, el nombre
y domicilio completo del destinatario.
3. Carta de rechazo emitida
por la autoridad sanitaria del país al que se exportó, donde se indique el
motivo del rechazo; en caso de no ser el rechazo por la autoridad un escrito en
hoja membretada de la empresa donde se indique el
motivo del retorno.
4. Carta del importador donde
indique cantidad, destino y uso del producto, lote y fecha de caducidad en su
caso, en papel membretado de la empresa.
Tratándose del Permiso Sanitario de Importación de Muestras de
alimentos, suplementos alimenticios, bebidas alcohólicas, bebidas no
alcohólicas, tabaco, productos de aseo, perfumería y belleza para consumo
personal, donación, para fines de investigación científica o pruebas de
laboratorio, se requiere presentar los siguientes documentos anexos a la
solicitud:
1. Factura o recibo que
indique muestras sin valor comercial, o guía aérea, marítima o terrestre que
ampare los productos a importar.
2. Carta que indique el uso
que le dará al producto.
ARTICULO TERCERO.- Se modifica el Anexo Unico del Acuerdo
por el que se dan a conocer los trámites inscritos en el Registro Federal de
Trámites Empresariales que aplica la Secretaría de Salud y se establecen
diversas medidas de mejora regulatoria y su Anexo Unico, publicado en el Diario
Oficial de la Federación el 14 de septiembre de 1998, en su parte relativa
al trámite de Permiso Sanitario de Importación de Materias Primas o
Medicamentos que sean o contengan Estupefacientes o Psicotrópicos, se debe
proporcionar también el nombre, domicilio y registro federal de contribuyentes
del facturador.
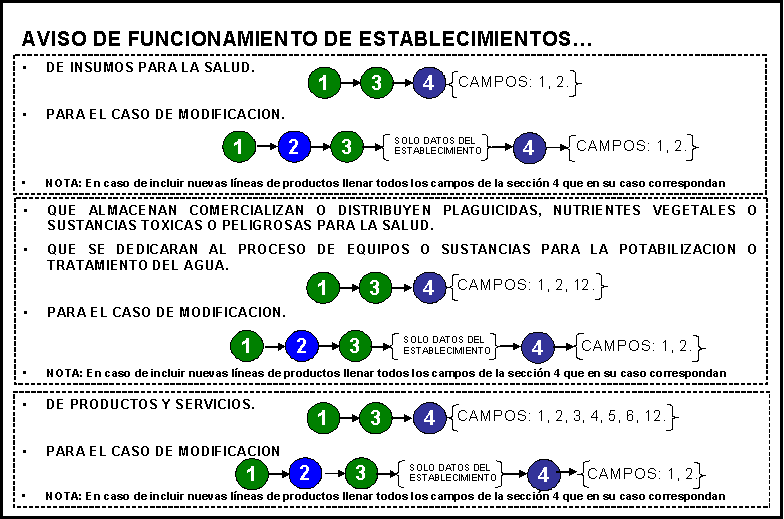
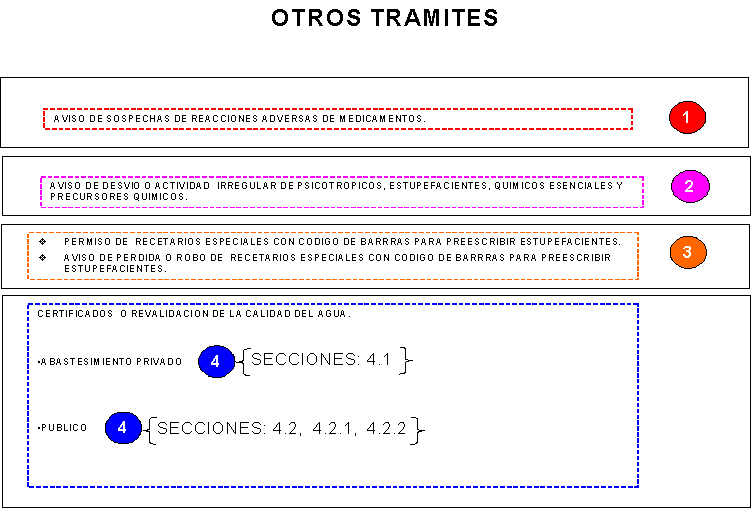
ARTICULO CUARTO.- Se dan a conocer los formatos únicos para la realización de los
siguientes trámites que aplica la Secretaría de Salud a través de la Comisión
Federal para la Protección contra Riesgos Sanitarios:
1. Solicitud de expedición de
licencia sanitaria de establecimientos de insumos para la salud.
2. Solicitud de modificación
a la licencia sanitaria de establecimientos de insumos para la salud.
3. Aviso de suspensión
temporal de la licencia sanitaria de establecimientos de insumos para la salud.
4. Aviso de reinicio de
actividades de establecimientos de insumos para la salud.
5. Aviso de baja de la licencia
sanitaria de establecimientos de insumos para la salud.
6. Aviso de modificación a la
licencia sanitaria de establecimientos de insumos para la salud.
7. Aviso de alta
funcionamiento de establecimientos de insumos para la salud.
8. Aviso de modificación del
aviso de funcionamiento de establecimientos de insumos para la salud.
9. Aviso de suspensión
temporal del aviso de funcionamiento de establecimientos de insumos para la
salud.
10. Aviso de reinicio de
actividades del aviso de funcionamiento de establecimientos de insumos para la
salud.
11. Aviso de baja del aviso de
funcionamiento de establecimientos de insumos para la salud.
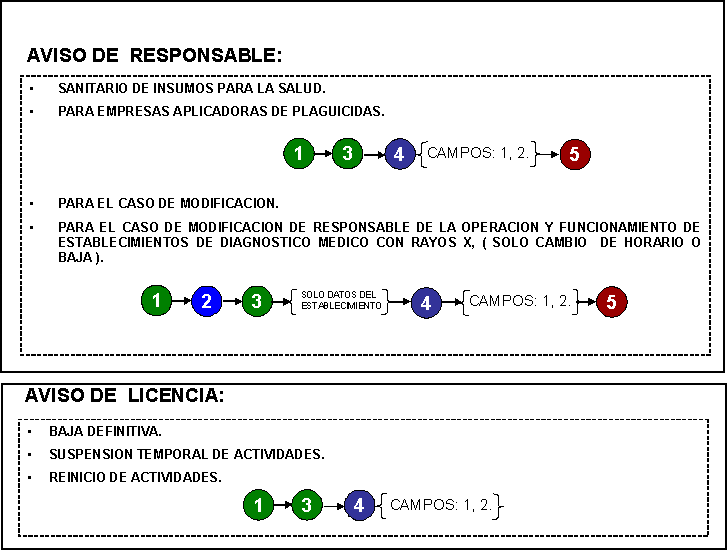
12. Aviso de designación de
responsable sanitario de insumos para la salud.
13. Aviso de designación del
responsable sanitario temporal de insumos para la salud.
14. Aviso de baja del
responsable sanitario de insumos para la salud.
15. Solicitud de registro
sanitario de medicamentos.
16. Solicitud de modificación a
las condiciones del registro sanitario de medicamentos.
17. Aviso de prórroga de plazos
para agotar existencias de medicamentos.
18. Solicitud de autorización
de protocolos de investigación de medicamentos.
19. Solicitud de autorización
de clave alfanumérica de remedios herbolarios.
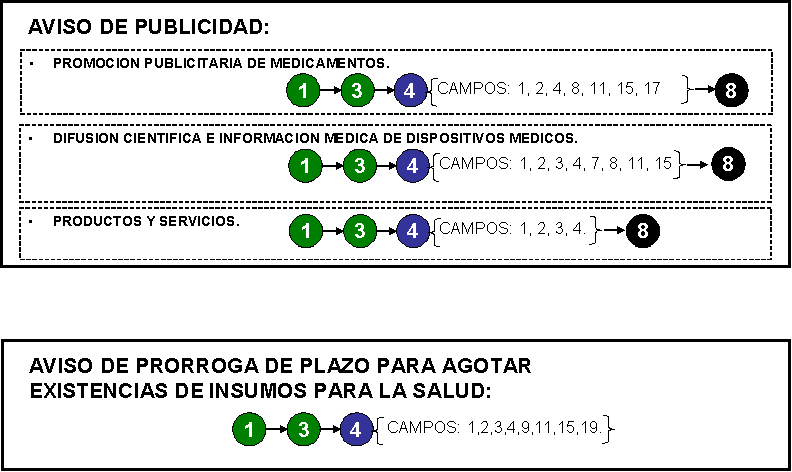
20. Aviso de promoción
publicitaria de medicamentos.
21. Solicitud de permisos para
venta o distribución de productos biológicos y hemoderivados.
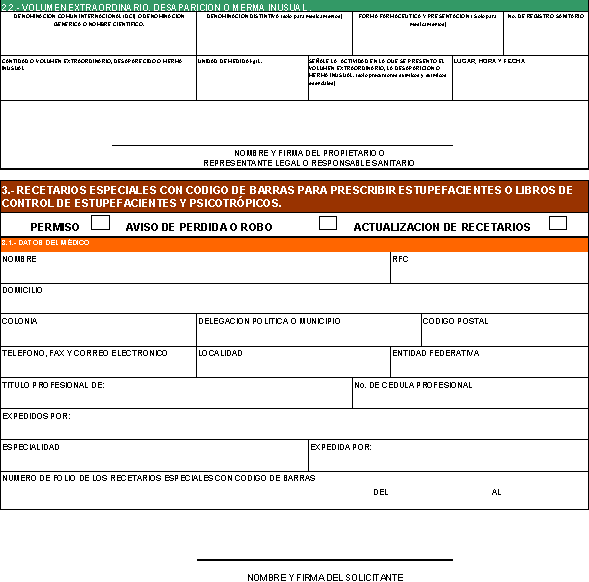
22. Solicitud de permiso para
utilizar recetarios especiales con código de barras para prescribir
estupefacientes.
23. Aviso de pérdida o robo de
recetarios especiales con código de barras para prescribir estupefacientes.
24. Solicitud de permiso de
adquisición en plaza de materias primas o medicamentos que sean o contengan
estupefacientes o psicotrópicos.
25. Solicitud de permiso de
libros de control de estupefacientes o psicotrópicos.
26. Solicitud de permiso de
liberación o muestreo de materias primas, fármacos y medicamentos que sean o
contengan estupefacientes o psicotrópicos.
27. Aviso de previsiones de
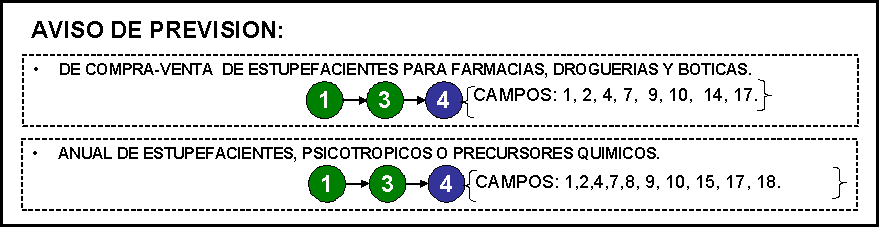
compra-venta de estupefacientes para farmacias, droguerías y boticas.
28. Aviso de previsiones
anuales de estupefacientes o psicotrópicos.
29. Solicitud de visitas de
verificación para estupefacientes o psicotrópicos.
30. Aviso de desvío o actividad
irregular de materia prima de fármacos o medicamentos que sean o contengan
estupefacientes o psicotrópicos.
31. Aviso de sospechas de
reacciones adversas de medicamentos.
32. Solicitud de registro
sanitario de dispositivos médicos.
33. Solicitud de modificaciones
a las condiciones del registro sanitario de dispositivos médicos.
34. Aviso de prórroga de plazos
para agotar existencia de dispositivos médicos.
35. Aviso de difusión
científica e información médica de dispositivos médicos.
36. Solicitud de permisos
sanitarios de importación o exportación de materias primas o medicamentos que
sean o contengan estupefacientes o psicotrópicos.
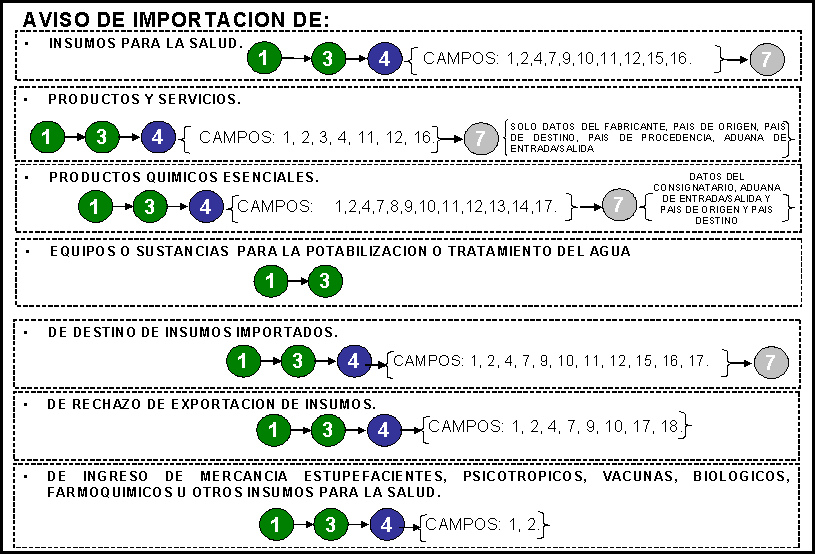
37. Solicitud de permiso
sanitario de importación de insumos para la salud.
38. Solicitud de certificado de
exportación de insumos para la salud.
39. Aviso de importación de
insumos para la salud.
40. Aviso de destino de insumos
importados.
41. Aviso de rechazo de
exportación de insumos.
42. Aviso de ingreso de mercancía
estupefacientes, psicotrópicos, vacunas, biológicos, farmoquímicos
u otros insumos para la salud.
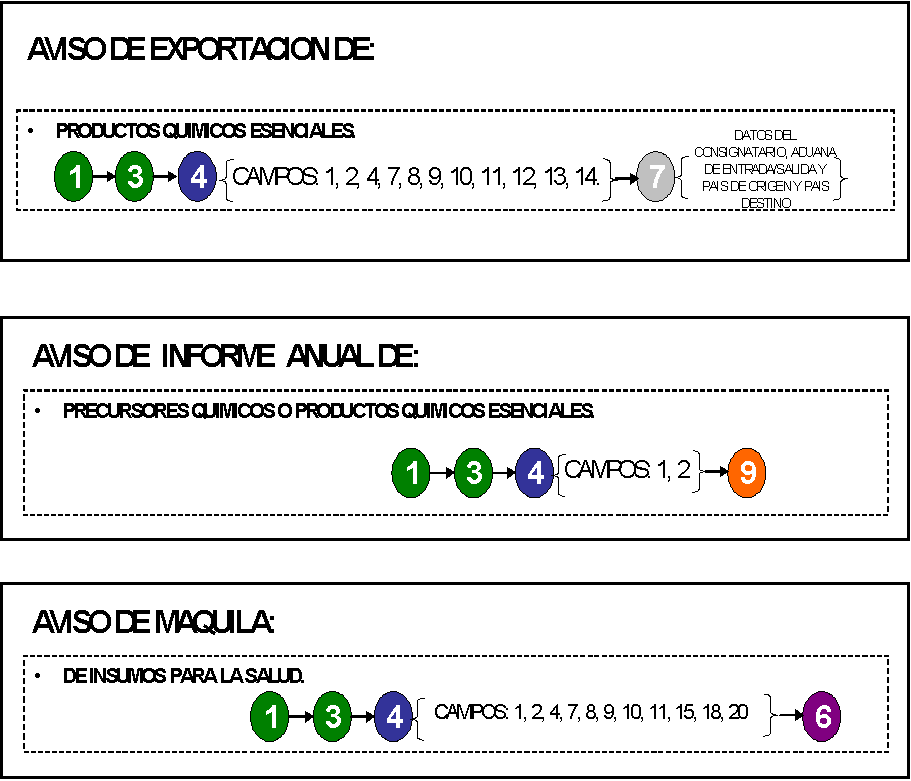
43. Aviso de información anual de
precursores químicos.
44. Solicitud de certificado de libre venta
de insumos para la salud.
45. Solicitud de certificado de buenas
prácticas de fabricación.
46. Solicitud de Autorización de Terceros.
47. Aviso de maquila de insumos para la
salud.
48. Aviso de funcionamiento de
establecimientos de productos y servicios.
49. Aviso de modificación del aviso de
funcionamiento de establecimientos de productos y servicios.
50. Aviso de suspensión temporal del aviso
de funcionamiento de establecimientos de productos y servicios.
51. Aviso de baja del aviso de
funcionamiento de establecimientos de productos y servicios.
52. Solicitud de permiso sanitario previo de
importación.
53. Solicitud de modificación al permiso
sanitario previo de importación.
54. Aviso sanitario de importación.
55. Solicitud de certificado para
exportación de libre venta.
56. Solicitud de certificado para
exportación de análisis de producto.
57. Solicitud de certificado para
exportación de conformidad de buenas prácticas sanitarias.
58. Solicitud de modificación del
certificado para exportación de libre venta, de análisis de producto y de
conformidad de buenas prácticas sanitarias.
59. Solicitud de visita de verificación
sanitaria para exportación.
60. Aviso de ubicación de máquinas
expendedoras de tabaco.
61. Aviso de funcionamiento de
establecimientos que almacenan, comercializan o distribuyen plaguicidas,
nutrientes vegetales o sustancias tóxicas o peligrosas para la salud.
62. Aviso de funcionamiento de
establecimientos que se dedicarán al proceso de equipos o sustancias para la potabilización o tratamiento de agua.
63. Solicitud de licencia sanitaria para
servicios urbanos de fumigación, desinfección y control de plagas.
64. Solicitud de licencia sanitaria; para
establecimientos que fabrican sustancias tóxicas o peligrosas para la salud.
65. Solicitud de licencia sanitaria para
establecimientos que fabrican, formulan, mezclan o envasan plaguicidas y
nutrientes vegetales.
66. Solicitud de licencia sanitaria para
establecimientos de diagnóstico médico con rayos X.
67. Solicitud de modificación a las
condiciones de la licencia sanitaria para servicios urbanos de fumigación,
desinfección y control de plagas; para establecimientos que fabrican sustancias
tóxicas o peligrosas para la salud; para establecimientos que fabrican,
formulan, mezclan o envasan plaguicidas y nutrientes vegetales; y para
establecimientos de diagnóstico médico con rayos X.
68. Aviso de modificación a las condiciones
de la licencia sanitaria para servicios urbanos de fumigación, desinfección y
control de plagas; para establecimientos que fabrican sustancias tóxicas o
peligrosas para la salud; para establecimientos que fabrican, formulan, mezclan
o envasan plaguicidas y nutrientes vegetales; y para establecimientos de
diagnóstico médico con rayos X.
69. Solicitud de permiso de responsable de
la operación y funcionamiento de establecimientos de diagnóstico médico con
rayos X.
70. Solicitud de modificación al permiso de
responsable de la operación y funcionamiento de establecimientos de diagnóstico
médico con rayos X.
71. Solicitud de permiso de asesor
especializado en seguridad radiológica para establecimientos de diagnóstico
médico con rayos X.
72. Solicitud de modificación al permiso de
asesor especializado en seguridad radiológica para establecimientos de
diagnóstico médico con rayos X.
73. Solicitud de permiso para modificaciones
a las instalaciones de establecimientos que manejan sustancias tóxicas o
peligrosas determinadas como alto riesgo para la salud cuando impliquen nuevos
sistemas de seguridad.
74. Aviso de información anual para
establecimientos con actividades de producción, preparación, enajenación,
adquisición, importación, exportación, transporte, almacenaje y distribución de
productos químicos esenciales.
75. Solicitud de certificado o revalidación
de la calidad del agua para uso y consumo humano en sistemas de abastecimiento
privados.
76. Solicitud de certificado o revalidación
de la calidad del agua para uso y consumo humano en sistemas de abastecimiento
públicos.
77. Aviso de importación de equipos o
sustancias para la potabilización o tratamiento del
agua.
78. Solicitud de dictamen sanitario de
efectividad bacteriológica de equipos o sustancias germicidas para potabilización de agua, tipo doméstico.
79. Solicitud de validación de la calidad
sanitaria del agua del área de producción de moluscos bivalvos y de las
especies que se cultivan y/o cosechan.
80. Solicitud de acreditación de
laboratorios de bacteriología y biotoxinas marinas en
apoyo al programa mexicano de sanidad de moluscos bivalvos.
81. Solicitud de acreditación de plantas de
empacado del programa mexicano de sanidad de moluscos bivalvos.
82. Aviso de importación o exportación de
productos químicos esenciales que no requieren permiso.
83. Aviso de desvío o actividades
irregulares de productos químicos esenciales.
84. Solicitud de certificado de cumplimiento
de normas oficiales mexicanas.
85. Aviso de responsable para empresas aplicadoras de plaguicidas.
86. Solicitud de permiso publicitario de
productos o servicios.
87. Aviso publicitario de productos o
servicios.
Los formatos con sus respectivas guías e instructivo de llenado, y
el listado de documentos que se deben presentar anexos a los mismos forman
parte integral del presente Acuerdo como Anexo Unico.
ARTICULO QUINTO.- La Comisión Federal para la Protección contra Riesgos Sanitarios
no exigirá formatos diversos, ni datos o documentos adicionales a los que se
publican mediante este Acuerdo, inscritos en el Registro Federal de Trámites y
Servicios, ni los aplicará en forma distinta a lo establecido en el mismo,
salvo en los casos a que se refiere el artículo 69-Q de la Ley Federal de
Procedimiento Administrativo.
ARTICULO SEXTO.- Este Acuerdo se refiere de manera exclusiva a los formatos de los
trámites que se presentan ante la Comisión Federal para la Protección contra
Riesgos Sanitarios; los formatos correspondientes a los trámites restantes que
se realicen ante otros órganos desconcentrados y unidades administrativas de la
Secretaría de Salud, no se ven afectados por el presente Acuerdo.
TRANSITORIOS
PRIMERO.- El presente Acuerdo entrará en vigor el 3 de noviembre de 2004.
SEGUNDO.- Los asuntos que se encuentren en trámite a la entrada en vigor del
presente Acuerdo se atenderán hasta su conclusión conforme a las disposiciones
vigentes al momento de su presentación.
TERCERO.- Las disposiciones contenidas en los instrumentos jurídicos que a
continuación se señalan, quedarán vigentes en lo que no se opongan al presente
Acuerdo:
1. Acuerdo por el que se dan
a conocer los trámites inscritos en el Registro Federal de Trámites
Empresariales que aplica la Secretaría de Salud y se establecen diversas medidas
de mejora regulatoria y su Anexo Unico,
publicados en el Diario Oficial de la
Federación el 14 de septiembre de 1998.
2. Aviso por el que se dan a
conocer los formatos que aplica la Dirección General de Salud Ambiental
publicado en el Diario Oficial de la
Federación el 28 de junio de 1999.
3. Aviso por el que se dan a
conocer los formatos de los trámites que aplica la Dirección General de Insumos
para la Salud publicado en el Diario
Oficial de la Federación el 28 de junio de 1999.
4. Aviso por el que se dan a
conocer los formatos de los trámites que aplica la Dirección General de Calidad
Sanitaria de Bienes y Servicios publicado en el Diario Oficial de la Federación el 28 de junio de 1999.
CUARTO.- Quedan sin efecto a partir de la entrada en vigor del presente
Acuerdo los siguientes instrumentos:
1. Aviso de modificaciones a
los formatos que aplica la Dirección General de Salud Ambiental en los trámites
SSA-05-007, SSA-05-015 y SSA-05-016 publicado en el Diario Oficial de la Federación el 11 de enero de 2000.
2. Acuerdo por el que se
modifica el Manual de Servicios al Público para la Importación de Mercancías
sujetas a control sanitario de bienes y servicios en lo relativo a los
requisitos del trámite de autorización sanitaria previa de importación, ahora permiso
sanitario previo de importación y el formato correspondiente, publicado en el Diario Oficial de la Federación el 12
de mayo de 2004.
3. Acuerdo por el que se
eliminan los requisitos que se indican para los trámites de solicitud de
certificado de libre venta de insumos para la salud y de aviso de responsable
sanitario de insumos para la salud, publicado en el Diario Oficial de la Federación de fecha 12 de agosto de 2004.
En la Ciudad de México, Distrito Federal, a los veinticinco días
de octubre de dos mil cuatro.- El Secretario de Salud, Julio José Frenk Mora.- Rúbrica.



|
PARA CUALQUIER ACLARACION, DUDA Y/O COMENTARIO CON
RESPECTO A ESTE TRAMITE, SIRVASE LLAMAR AL SISTEMA DE ATENCION TELEFONICA A
LA CIUDADANIA (SACTEL) A LOS TELEFONOS 5-480-2000 EN EL D.F.
Y AREA METROPOLITANA, DEL INTERIOR DE LA REPUBLICA SIN COSTO PARA EL USUARIO
AL 01800-0014800 O DESDE ESTADOS UNIDOS Y CANADA AL 1888-5943372, O A LOS
TELEFONOS
50-80-54-40, 50-80-54-41, 50-80-54-47, 50-80-54-74 DE LA COFEPRIS, EN EL D.F. Y AREA METROPOLITANA, DEL INTERIOR DE LA REPUBLICA
SIN COSTO PARA EL USUARIO AL 01-800-420-4224
|

INSTRUCTIVO DE LLENADO FORMATO SOLICITUDES
1. SOLICITUD
DE:
Marque
con una “X” la figura de acuerdo a la solicitud a realizar y escriba el NOMBRE
DEL TRAMITE correspondiente de acuerdo a cada lista en el espacio
correspondiente.
LICENCIA SANITARIA: Los
establecimientos que requieren licencia sanitaria son aquellos citados en el
artículo 198 de la Ley General de Salud.
1) El
proceso (obtención, elaboración, fabricación, preparación, conservación,
mezclado, acondicionamiento, envasado, manipulación, transporte, distribución,
almacenamiento y expendio o suministro al público) de los medicamentos que
contengan estupefacientes y psicotrópicos; vacunas; toxoides;
sueros y antitoxinas de origen animal
y hemoderivados;
2) La
elaboración, fabricación o preparación de plaguicidas, nutrientes vegetales,
sustancia tóxicas o peligrosas;
3) La
aplicación de plaguicidas;
4) la
utilización de fuentes de radiación para fines médicos o de diagnóstico.
Alta
o nuevo Alta de la
licencia sanitaria.
Modificación A las condiciones de la
licencia sanitaria, modificación de instalaciones. En caso de elegir esta
opción llenar también la sección 2 del formato.
REGISTRO: 1) Sanitario de dispositivos médicos. Sólo
un producto por solicitud.
2) Sanitario de medicamentos. Sólo un producto
por solicitud.
Alta
o nuevo Nuevo
registro sanitario de insumos para la salud.
Modificación A las condiciones del
registro de insumos para la salud. En caso de elegir esta opción llenar también
la sección 2 del formato.
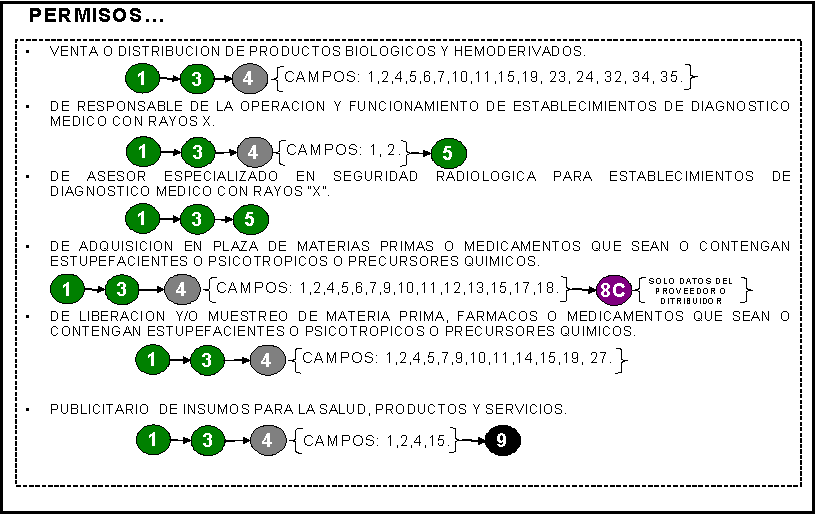
PERMISO: 1) Para venta o distribución de productos
biológicos y hemoderivados.
2) De responsable de la operación y
funcionamiento de establecimientos de diagnóstico médico con rayos x. (sólo
alta y modificación)
3) De asesor especializado en seguridad
radiológica para establecimientos de diagnóstico médico con rayos x.
4) De adquisición en plaza de materias
primas o medicamentos que sean o contengan psicotrópicos y precursores
químicos.
5) De liberación y/o muestreo de materias
primas, fármacos y medicamentos que sean o contengan estupefacientes o
psicotrópicos o precursores químicos.
6) Publicitario de productos y servicios.
Alta
o Nuevo Nuevo
permiso.
Modificación En caso de elegir esta
opción llenar también la sección 2 del formato.
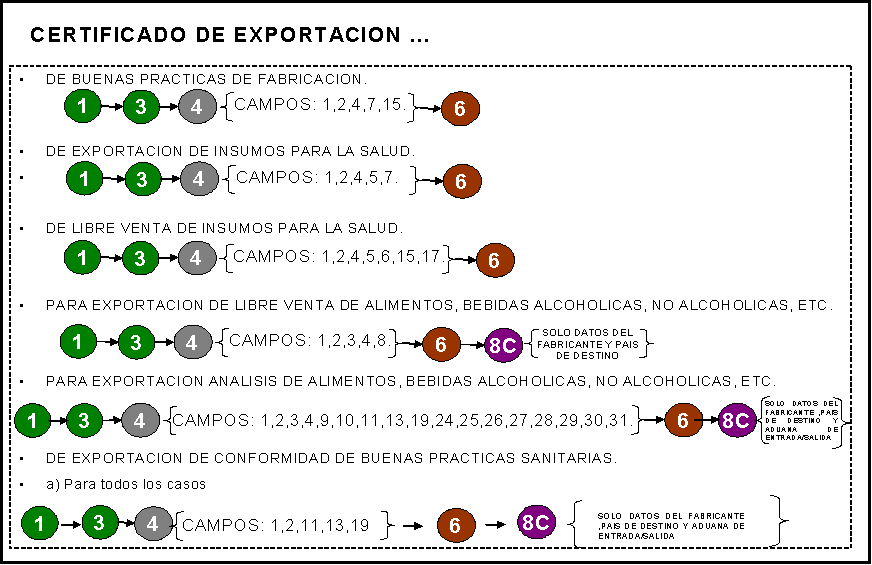
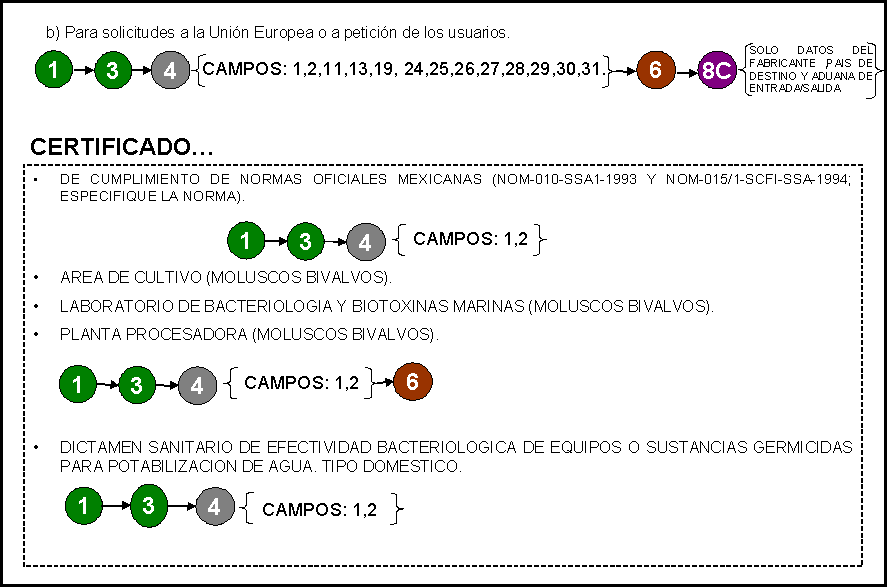
CERTIFICADO:
1) De Cumplimiento de Normas Oficiales
Mexicanas (NOM-010-SSA1-1993 y
NOM-015/1-SCFI-SSA-1994; especifique la norma).
2) De efectividad bacteriológica
PARA EXPORTACION 3) Del área de cultivo (moluscos bivalvos).
4) De laboratorio de bacteriología y biotoxinas marinas (moluscos bivalvos).
5) De planta procesadora (moluscos
bivalvos).
6) De buenas prácticas de fabricación.
7) Para exportación de insumos para la
salud.
8) De libre venta de insumos para la salud
[dispositivos médicos; medicamentos (alopáticos, biomedicamentos,
alimentación enteral, vacunas, hemoderivados,
homeopático, herbolario, vitamínico), remedios herbolarios]. Sólo un producto
por solicitud.
9) Para exportación de libre venta
(alimentos, suplementos alimenticios, bebidas alcohólicas y no alcohólicas,
tabaco, aseo y limpieza, perfumería y belleza)
10) Para exportación análisis de producto.
11) Para exportación de conformidad con buenas
prácticas sanitarias.
Alta
o Nuevo Nuevo
certificado.
Modificación. Al certificado. En caso
de elegir esta opción llenar también la sección 2 del formato.
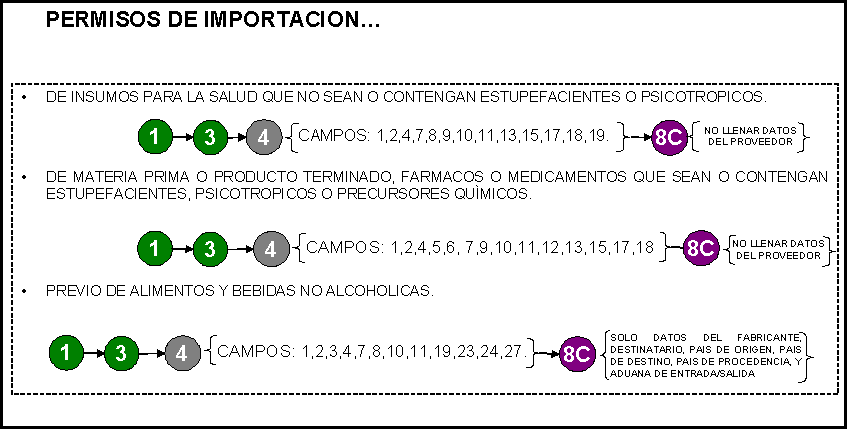
PERMISO DE IMPORTACION/EXPORTACION:
1) Sanitario de importación de insumos para
la salud y que no contengan o sean estupefacientes o psicotrópicos.
2) Sanitario de importación o exportación de
materias primas, fármacos o medicamentos que sean o contengan estupefacientes,
Psicotrópicos y precursores químicos.
3) Sanitario previo de importación.
(Alimentos, suplementos alimenticios, bebidas alcohólicas y no alcohólicas,
tabaco, aseo y limpieza, perfumería y belleza). Indicar en la sección 1 “NOMBRE
DEL TRAMITE” cuando se trate de muestra o consumo personal.
Primera
vez En caso de
que el permiso de importación fuera primera vez.
Subsecuente En
caso de que el permiso de importación fuera consecutivo.
Temporal En caso de que el producto
permanezca en el territorio nacional por tiempo limitado.
Definitiva En caso de que el producto
permanezca en el territorio nacional por tiempo ilimitado.
Modificación Del permiso sanitario
previo de importación. En caso de elegir esta opción llenar también la sección
2 del formato.
Prórroga. Extensión a la
vigencia de los permisos
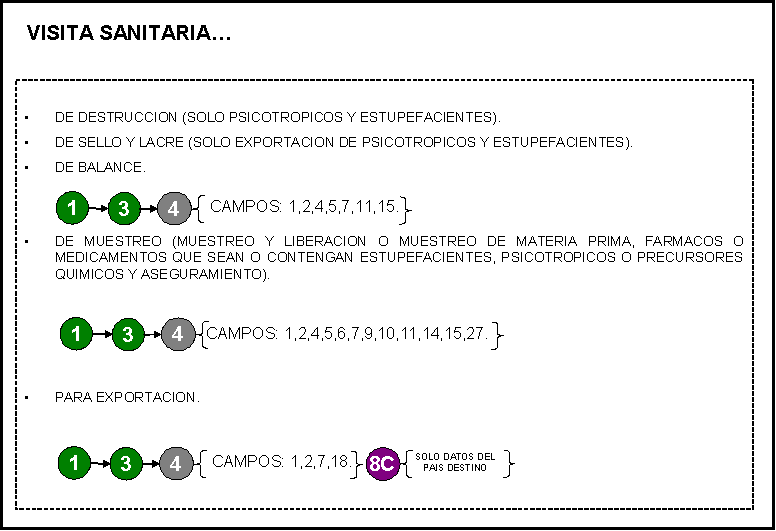
VISITA SANITARIA: 1) De muestreo de producto para exportación.
2) De destrucción
3) De sello y lacre (sólo exportación de
psicotrópicos y estupefacientes).
4) De balance.
5) De muestreo (muestreo y liberación o
muestreo de materia prima, fármacos o medicamentos que sean o contengan
estupefacientes, psicotrópicos o precursores químicos y aseguramiento).
6) Para exportación.
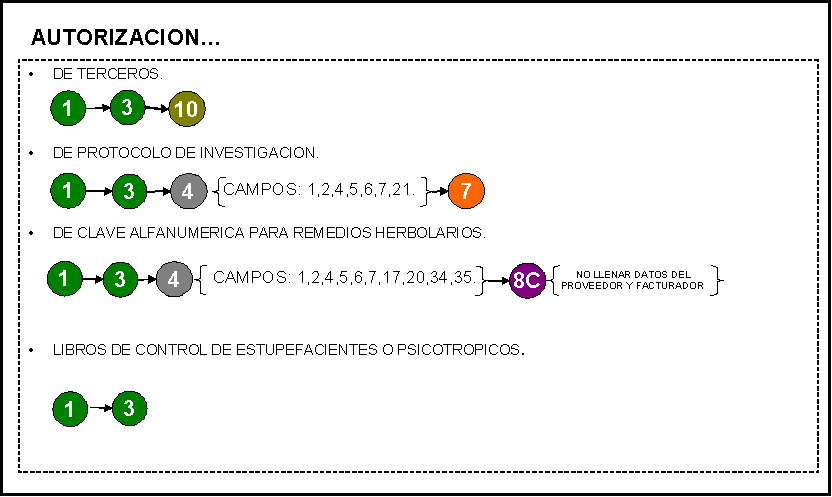
AUTORIZACION: 1) De terceros.
2) De protocolo de investigación de
medicamentos o dispositivos médicos (en fase de investigación). Sólo un
producto por solicitud.
3) De la clave alfanumérica de remedios
herbolarios.
4) Libros de control de estupefacientes o
psicotrópicos.
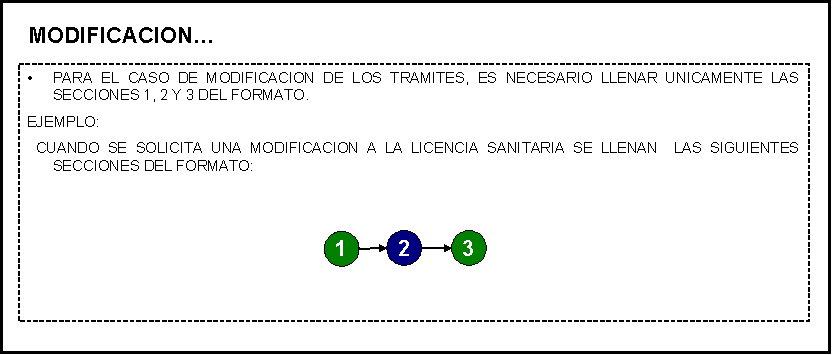
2. MODIFICACION
DE: (sólo en caso de haber seleccionado este campo en la sección 1)
En el campo NUMERO DE DOCUMENTO A
MODIFICAR escriba el número del documento y anote la modificación a realizar en
el campo correspondiente de acuerdo a la siguiente lista enunciativa más no
limitativa.
1) Razón social
2) Nuevas líneas o servicios.
3) Domicilio.
4) Producto.
5) Proceso.
6) Cesión de derechos.
7) Propietario.
8) Línea o giro.
9) A las condiciones de registro de
medicamentos.
10) A las condiciones de registro de
dispositivos médicos.
11) Responsable de operación y funcionamiento o
de asesor especializado en seguridad radiológica para establecimientos de
diagnóstico médico con rayos X.
12) A las instalaciones de establecimientos que
manejan sustancias tóxicas o peligrosas determinadas como de alto riesgo para
la salud, cuando impliquen nuevos sistemas de seguridad.
Dice/Condición
autorizada Anote los
datos que se desea modificar, como se encuentran actualmente en la autorización
otorgada.
Debe
decir/Condición solicitada Anote
los datos como desea que deben quedar.
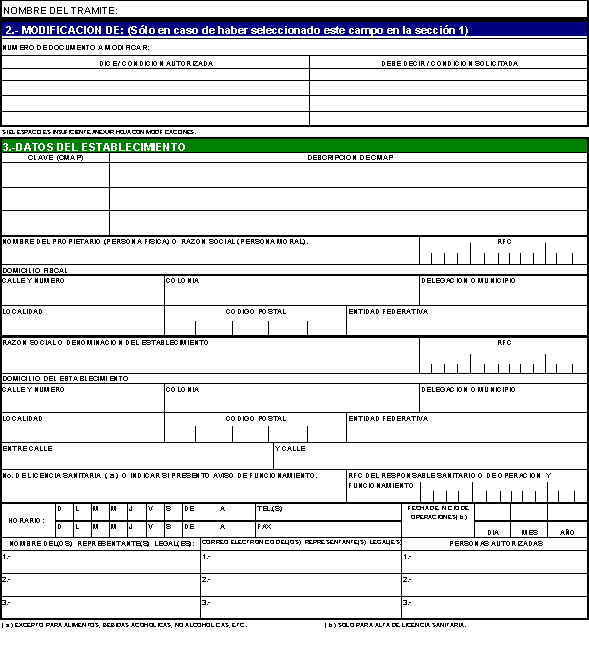
3. DATOS DEL ESTABLECIMIENTO
|
Clave CMAP
|
Número completo de la
Clasificación Mexicana de Actividades y Productos (CMAP).
|
|
Descripción de CMAP
|
Descripción bajo la cual
se registra el establecimiento de acuerdo a la clave CMAP (Clasificación
Mexicana de Actividades y Productos).
|
|
Nombre del Propietario (persona
física) o razón social (persona moral)
|
Nombre completo sin
abreviaturas (persona física o moral) bajo el cual se encuentra registrado el
establecimiento ante la Secretaría de Hacienda y Crédito Público (domicilio
fiscal).
|
|
RFC
|
El Registro Federal de
Contribuyentes bajo el cual está registrado el propietario ante la SHyCP.
|
|
Calle y número
|
Nombre completo sin
abreviaturas de la calle en la que se ubica el domicilio del propietario.
|
|
Colonia
|
Nombre completo sin
abreviaturas de la colonia en donde se ubica el domicilio del propietario.
|
|
Delegación o municipio
|
Nombre completo sin
abreviaturas de la delegación política o municipio en donde se ubica el
domicilio del propietario.
|
|
Localidad
|
Localidad en donde se
encuentra el domicilio del propietario.
|
|
Código postal
|
Número completo del código
postal que corresponda el domicilio del propietario.
|
|
Entidad federativa
|
Entidad federativa en
donde se encuentra el domicilio del propietario.
|
|
Razón social o denominación
|
Nombre completo sin abreviaturas
del establecimiento (Ej. “Farmacia Lupita”).
|
|
RFC
|
El Registro Federal de
Contribuyentes bajo el cual está registrado el establecimiento ante la SHyCP.
|
|
Calle y número
|
Nombre
completo sin abreviaturas de la calle en la que se ubica ell
establecimiento.
|
|
Colonia
|
Nombre
completo sin abreviaturas de la colonia en donde se ubica el establecimiento.
|
|
Delegación o municipio
|
Nombre
completo sin abreviaturas de la delegación política o municipio en donde se ubica
el establecimiento.
|
|
Localidad
|
Localidad
en donde se encuentra el establecimiento.
|
|
Código postal
|
Número
completo del código postal que corresponda.
|
|
Entidad federativa
|
Entidad
federativa en donde se encuentra el establecimiento.
|
|
Entre calle
|
Entre
que calle se encuentra el establecimiento.
|
|
Y calle
|
Y
que calle se encuentra el establecimiento.
|
|
No. de Licencia Sanitaria o
indique presentó aviso de funcionamiento
|
Número
de la licencia sanitaria o indicar si presentó el aviso de funcionamiento. No
aplica para el trámite de terceros autorizados como si laboratorios de prueba
o unidades de verificación.
|
|
RFC del responsable sanitario
o de operación.
|
RFC
del responsable sanitario o de operación bajo el cual se encuentra registrado
ante la Secretaría de Hacienda y Crédito Público. No aplica para establecimientos
que manejan alimentos, bebidas no alcohólicas, bebidas alcohólicas;
perfumería y belleza; aseo; tabaco y terceros autorizados como laboratorios
de prueba o unidades de verificación.
|
|
Horario
|
Cruce
con una X los días de la semana que estará abierto el establecimiento y
escriba el horario de atención al público apertura y cierre (DE ___ A__).
|
|
Teléfono(s).
|
Número(s)
telefónico(s) con clave lada.
|
|
Fax
|
Número
de fax con clave lada.
|
|
Fecha de inicio o reinicio de operaciones
|
Indicar
día, mes y año (Sólo en caso de alta de licencia sanitaria).
|
|
Nombre y correo electrónico del(os)
representante(s) legal(es)
|
Nombre
completo sin abreviaturas del(os) representante(s) legal(es) y su correo electrónico
(e-mail). (En caso de personas físicas puede ser el propietario)
|
|
Personas autorizadas
|
Nombre
completo de las personas autorizadas para entregar y recibir respuesta de
trámites ante la COFEPRIS
|
|
|
|
4. DATOS
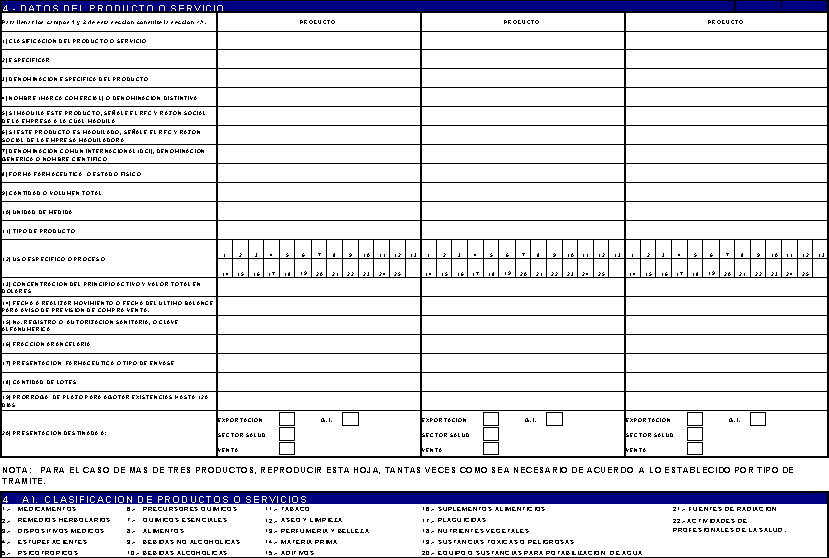
ESPECIFICOS DEL PRODUCTO: INFORMACION GENERAL
|
1 Clasificación del producto
o servicio.
|
Escriba
el nombre de la clasificación del producto o servicio para el cual va a
realizar su trámite. Consulte tabla 4A. del formato para llenar este campo.
|
|
2 Especificar.
|
Si
el producto pertenece a una subclasificación del
producto elegido en la tabla 4 A. del formato; consulte la tabla 4 A de este
instructivo y elija de la lista de cada producto el nombre de la
clasificación específica al cual pertenece.
Para
la exportación de productos pesqueros a la Unión Europea escriba si el
producto es de “acuacultura” o en su caso de la “pesca”.
|
|
3 Denominación específica del
producto.
|
Nombre
particular que recibe un producto y que se encuentra asociado a la(s) característica(s)
que lo distingue(n) dentro de una clasificación general y lo restringe(n) en
aplicación, efecto, estructura, función y uso particular excepto
medicamentos. (Por ejemplo: Leche ultra pasteurizada descremada con sabor
chocolate, Catéter para angioplastia coronaria con
globo).
|
|
4 Nombre (marca comercial) o
denominación distintiva.
|
Marca
con la que se comercializa el producto. Para insumos para la salud, el nombre
que como marca comercial le asigna el laboratorio o fabricante a sus especialidades
farmacéuticas con el fin de distinguirlas de otras similares (ejemplo: “Lala”, “Agiocat”).
|
|
5 Denominación Común
Internacional (DCI), Nombre Científico o Denominación Genérica.
|
Para
el caso de medicamentos, la DCI y la denominación genérica es el nombre que
identifica al fármaco o sustancia activa reconocido internacionalmente.
Ejemplo Ampicilina. Para el caso de dispositivos
médicos. Ejemplo Catéter.
Para
el caso de Remedios Herbolarios, especificar el nombre científico (género y especie)
de la planta o sus partes. Ejemplo Heterotheca inuloides
(Arnica
Mexicana).
Para
el caso de otros productos la denominación Genérica representa cada uno de
los distintos tipos o clases en que se puedan agrupar. Ejemplo: Leche.
|
|
6 Forma farmacéutica o forma física
|
Forma farmacéutica a la
mezcla de uno o más fármacos con o sin aditivos, que presentan ciertas
características físicas para su adecuada dosificación, conservación y
administración (tabletas, suspensiones, etc.); y el estado físico puede ser:
sólido, líquido y gaseoso.
|
|
7 Tipo
del producto
|
Seleccione el número
correspondiente al tipo de producto 1.- materia prima,
2.- aditivo, 3.- producto terminado, 4.- producto a granel, 5.- otros (cualquiera
que no entre dentro de la clasificación anterior)
|
|
8 Fracción
arancelaria
|
Clasificación arancelaria
a la que pertenece la mercancía a importar.
|
|
9 Cantidad
de lotes
|
Anotar con número la cantidad
de lotes a adquirir, exportar, importar o adquisición en plaza o bien
especificar el número de lotes a liberar.
De psicotrópicos y estupefacientes y alimentos, suplementos alimenticios, bebidas alcohólicas y no alcohólicas, tabaco, aseo
y limpieza, perfumería y belleza
|
|
10 Unidad
de medida.
|
Abreviatura de acuerdo al
sistema internacional de unidades para el caso de alimentos, suplementos
alimenticios, bebidas alcohólicas y no alcohólicas, tabaco, aseo y limpieza,
perfumería y belleza. En el caso de medicamentos deberá corresponder con la
forma farmacéutica solicitada.
|
|
11 Cantidad
o volumen total.
|
Escribir con números
arábigos la cantidad o volumen total de producto importado, exportado. Para el
caso de estupefacientes, psicotrópicos y precursores químicos la cantidad
total debe ser de materia prima. Cuando aplique.
|
|
12 No.
de piezas a fabricar.
|
Escribir la cantidad con
número de piezas a fabricar. (Tabletas, cápsulas, ampolletas, etc.)
|
|
13 kg o g por lote
|
Escribir la cantidad en kg. o g por lote, sólo para estupefacientes y
psicotrópicos o farmoquímicos.
|
|
14 No.
de permiso sanitario de importación
|
Escribir el número de
permiso sanitario de importación (aplica únicamente para liberación de
estupefacientes y psicotrópicos y venta o distribución de biológicos y
hemoderivados).
|
|
15 No.
de registro sanitario o clave alfanumérica.
|
Número del registro
sanitario o clave alfanumérica del producto emitido por la autoridad
sanitaria.
|
|
16 No.
de acta.
|
Escribir el No. de acta
de liberación. Sólo en caso de liberación de psicotrópicos y estupefacientes.
|
|
17 Presentación
|
Presentación por unidad:
para los medicamentos (frasco con 120 ml, caja con
20 tabletas de 5 mg. etc.) y dispositivos médicos
(envase con una pieza, frasco con 240 ml, caja o
bote con 100 tiras reactivas, etc.). Para el caso de alimentos, bebidas
alcohólicas y no alcohólicas, tabaco, aseo y limpieza, perfumería y belleza y
suplementos alimenticios (caja con 10 botes, botella de 200 ml, lata de 250 g, marqueta de 10 kg,
etc.).
|
|
18 Uso
específico o proceso.
|
Escriba el o los números
correspondientes al uso específico o proceso que se le dará al producto de
acuerdo a la siguiente lista: 1.- Obtención,
2.- Elaboración, 3.- Preparación, 4.- Fabricación, 5.- Formulación. 6.-
Mezclado, 7.- Envasado, 8.- Conservación, 9.- Acondicionamiento, 10.-
Almacenamiento, 11.- Manipulación, 12.-
Distribución, 13.- Transporte, 14.- Venta o comercialización, 15.-
Maquila, 16.- Donaciones, 17.- Análisis, 18.- Investigación científica, en
laboratorio o experimentación, 19.- Muestra, 20.- Promoción, 21.- Proyectos,
22.- Transferencia, 23.- Uso directo o aplicación, 24.- Uso o consumo
personal. Indicar tantos usos o procesos como se requieran de acuerdo al tipo
de aviso y producto (por ejemplo elaboración y acondicionamiento).
|
|
19 Clave
del (los) lote(s)
|
Número o clave que tienen
los lotes.
|
|
20 Indicaciones
Sintomáticas.
|
En orden de importancia los
síntomas que contrarresta el producto.
|
|
21 Concentración
|
Escribir la concentración
del producto en porcentaje.
|
|
22 Indicación
terapéutica o indicación de uso
|
La acción del producto en
orden de importancia. (para medicamentos
o dispositivos médicos)
|
|
23 Fecha
de fabricación
|
Fecha en la que se
fabricó el producto.
|
|
24 Fecha
de caducidad
|
Fecha en la que el
producto estará caduco.
|
|
25 Temperatura
de almacenamiento
|
Especificar en °C la temperatura de almacenamiento del producto.
|
|
26 Temperatura
de transporte
|
Especificar en °C la temperatura de transporte del producto.
|
|
27 Medio
de transporte o aduana de entrada.
|
Especificar el medio de transporte
o aduana de entrada para el caso de visita y permiso de liberación y muestreo
de psicotrópicos y estupefacientes.
|
|
28 Identificación
de Contenedores
|
Escribir el número o
números de los contenedores en los que transporta ell producto.
|
|
29 Envase
Primario
|
Material con que está
hecho el envase que se encuentra en contacto directo con el producto, así
como sus especificaciones y capacidad.
|
|
30 Envase
Secundario
|
Material con que está hecho
el envase, que puede contener uno más envases, así como sus especificaciones
y capacidad.
|
|
31 Tipo
de Embalaje y No. de Unidades de Embalaje
|
Especifique el tipo de
embalaje (contenedores, cajas, etc.) y No. de unidades de embalaje.
|
|
32 No.
de partida
|
Indicar el número de
partida correspondiente.
|
|
33 Clave
del cuadro básico o catálogo del sector salud (CBSS)
|
Clave
del cuadro básico o catálogo del sector salud al que pertenece el producto.
|
|
34 Presentación
destinada a:
|
Cruce con una “X” de
acuerdo a la presentación que corresponda para su venta del producto (sólo
registro de insumos para la salud).
|
|
35 Fabricación
del Producto:
|
Cruce con una “X” si el
producto declarado es de fabricación nacional o extranjera.
|
4 A)
CLASIFICACION DEL PRODUCTO O SERVICIO.
Consulte la siguiente clasificación del
producto o servicio y elija el producto para el cual va a realizar el trámite;
Utilice esta información para llenar la sección 4 los campos 1 y 2 del formato.
|
1.
|
MEDICAMENTOS/FARMACO
|
Art. 224 LGS. I)
Alopáticos
|
II) Homeopáticos.
|
III) Herbolarios.
|
|
2.
|
DISPOSITIVOS MEDICOS (Artículo 262 sección I al VI de la Ley General de
Salud)
|
I) Equipo o instrumental médico.
III) Agentes de
diagnóstico.
V) Materiales quirúrgicos y de curación
|
II) Prótesis, órtesis y ayudas funcionales.
IV) Insumos de uso odontológico.
VI) Productos higiénicos.
|
|
3.
|
REMEDIOS HERBOLARIOS
|
El preparado de plantas
medicinales, o sus partes, individuales o combinadas y sus derivados,
presentado en forma farmacéutica, al cual se le atribuye por conocimiento
popular o tradicional, el alivio de algunos síntomas participantes o aislados
de una enfermedad.
|
|
4.
|
BIOLOGICOS
|
Art. 229 LGS,
I) Toxoides, vacunas y preparaciones bacterianas de
uso parenteral;
II) Vacunas virales de uso oral o parenteral.
III) Sueros y antitoxinas de origen animal;
IV) Hemoderivados;
|
V) Vacunas y preparaciones microbianas de uso
oral;
VI) Materiales biológicos para diagnóstico que se administran al paciente;
VII) Antibióticos.
VIII) Hormonas macromoleculares y enzimas.
|
|
5.
|
ESTUPEFACIENTES
|
Especificar
estupefaciente (remitirse al CAPITULO V artículo 234 de la Ley General de
Salud y anexos).
|
|
6.
|
PSICOTROPICOS.
|
Especificar
psicotrópico (remitirse al CAPITULO VI artículo 245 de la Ley General de
Salud y anexos).
|
|
7.
|
PRECURSORES QUIMICOS
|
Especificar
precursor químico (remitirse a la Ley Federal para Control de Precursores
Químicos, Productos Químicos Esenciales y Máquinas para Elaborar Cápsulas,
Tabletas y/o Comprimidos).
|
|
8.
|
ALIMENTOS
|
Cualquier
sustancia o producto, sólido o semisólido, natural o transformado, que
proporcione al organismo elementos para su nutrición. Y sus aditivos.
|
|
9.
|
MOLUSCOS BIVALVOS
|
Almeja,
ostión, mejillón.
|
|
10.
|
BEBIDAS NO ALCOHOLICAS
|
Cualquier
líquido, natural o transformado que proporcione al organismo elementos para
su nutrición.
|
|
11.
|
BEBIDAS ALCOHOLICAS
|
Se
consideran bebidas alcohólicas aquellas que contengan alcohol etílico en una proporción
de 2% y hasta 55% en volumen. Cualquier otra que contenga una proporción
mayor no podrá comercializarse como bebida (artículo 217 de la Ley General de
Salud).
|
|
12.
|
TABACO
|
Productos
que contengan “Nicotina tabacum” en sus diferentes presentaciones,
que se utilicen para fumar, masticar, o aspirar (artículo 275 de la Ley
General de Salud).
|
|
13.
|
ASEO Y LIMPIEZA
|
I) Jabones
II) Detergentes
III) Limpiadores
IV) Blanqueadores
|
V) Almidones para uso externo
VI) Desmanchadores
VII) Desinfectantes
VIII) Desodorantes y aromatizantes ambientales
|
|
14.
|
PERFUMERIA Y BELLEZA
|
Según
artículo 269 de la LGS.
|
|
15.
|
PROCEDIMIENTOS DE EMBELLECIMIENTO
|
Todos
aquellos servicios y procedimientos que se utilicen para modificar las
características del cuerpo humano, mediante: la práctica de técnicas físicas,
la acción de aparatos o equipos, y la aplicación de productos y métodos.
|
|
16.
|
SUPLEMENTOS ALIMENTICIOS
|
Cualquier
producto a base de hierbas, extractos vegetales, alimentos tradicionales,
deshidratados o concentrados de frutas, adicionados o no, de vitaminas o
minerales, que se pueden presentar en forma farmacéutica y cuya finalidad de
uso sea incrementar la ingesta dietética total, complementarla o suplir
alguno de sus componentes.
|
|
17.
|
CERAMICA
|
Para
el caso de certificado de la NOM-010.
|
|
18.
|
JUGUETES
|
Para
el caso de certificado de la NOM-015.
|
|
19.
|
PLAGUICIDAS
|
I) Grado técnico
|
II) Formulado
|
|
20.
|
NUTRIENTES VEGETALES (FERTILIZANTES)
|
I) Formulado.
|
|
|
21.
|
FUENTES DE RADIACION (DIAGNOSTICO)
|
Servicios
de radiografía convencional, fluoroscopia, mamografía, tomografía, panorámica
dental o hemodinamia.
|
|
22.
|
SUSTANCIAS TOXICAS O PELIGROSAS
|
I) Químico básico orgánico
|
II) Químico básico inorgánico
|
|
|
OTROS INSUMOS
|
I) Vitamínicos.
|
II) Biomedicamentos.
|
|
23.
|
OTRAS FUENTES DE RADIACION IONIZANTE QUE
DETERMINE LA SSA (TRATAMIENTO).
|
I) Braquiterapia
|
II) Radioterapia externa
|
|
24.
|
EQUIPOS O SUSTANCIAS PARA LA
POTABILIZACION DE AGUA.
|
I) Equipos
|
II) Sustancias
|
|
|
|
|
|
|
5.- DATOS DEL RESPONSABLE DE O ASESOR
ESPECIALIZADO.
Nombre Nombre
completo sin abreviaturas del responsable de operación y funcionamiento o
asesor especializado en seguridad radiológica.
RFC Registro
Federal de Contribuyentes del responsable de operación y funcionamiento o
asesor especializado en seguridad radiológica.
Calle y número Nombre
completo sin abreviaturas de la calle en la que se ubica el domicilio fiscal
del responsable de operación y funcionamiento o asesor especializado en
seguridad radiológica.
Colonia Nombre
completo sin abreviaturas de la colonia en donde se ubica el domicilio fiscal
del asesor especializado.
Delegación o municipio Nombre completo sin
abreviaturas de la delegación política o municipio en donde se ubica el
domicilio fiscal del asesor especializado.
Localidad Localidad
en donde se encuentra el domicilio fiscal del asesor especializado.
Código Postal Número
completo del código postal que corresponda al domicilio fiscal del asesor
especializado.
Entidad Federativa Entidad
Federativa en donde se encuentra el domicilio fiscal del asesor especializado.
Horario de labores Cruce con una X
los días de la semana que estará en el establecimiento el responsable de
operación y funcionamiento y escriba el horario de permanencia.
Con título profesional de: Nombre del título
profesional del responsable de operación y funcionamiento o asesor
especializado.
Expedido por: Nombre
de la Institución Educativa que expidió el título.
No. de cédula profesional. Número de la cédula
profesional del responsable de operación y funcionamiento o asesor
especializado.
Número de certificado y
vigencia Escriba el número de
certificado expedido por el Consejo Mexicano de Radiología e Imagen, A.C. y la fecha de vencimiento. Sólo para responsable de
operación y funcionamiento.
Servicios que pretende
prestar Escriba los servicios
que pretende prestar el asesor especializado en seguridad radiológica.
6.- INFORMACION PARA CERTIFICADOS
País de
destino A
petición del interesado señalar el nombre del país que requiera del certificado
en cuestión.
Especificar características A petición del interesado
señalar cuando aplique las características e información que debe contener el
certificado solicitado. (Ejemplo: Para exportación a la Unión Europea
especificar si son de acuacultura o de la pesca).
NOTA: Para certificados de
buenas prácticas de fabricación a petición del interesado señalar cuando
aplique para registro de dispositivos médicos o licitaciones.
7.- PROTOCOLO DE INVESTIGACION (DE
MEDICAMENTOS Y DISPOSITIVOS MEDICOS).
Título del protocolo a
investigar. Nombre completo sin claves, ni abreviaturas del
título del protocolo a investigar.
Vía de
administración Para
medicamentos: Oral, intravenosa, intramuscular, etc. de acuerdo a su
presentación.
Para
dispositivos médicos: Productos implantables, uso
tópico, mucosas, etc.
Nombre
del investigador principal. Nombre
completo con cargo sin abreviaturas del investigador encargado.
Nombre(s)
de la(s) institución(es) donde se realiza la investigación Nombre completo sin abreviaturas de la(s)
institución(es) que llevará a
cabo la investigación.
DATOS DE CON QUIEN EFECTUA LA OPERACION.
8.- A).
PARA REGISTRO (MAQUILA NACIONAL)
|
Nombre
del maquilador
|
El
nombre completo del maquilador nacional.
|
|
R.F.C.
|
Registro
Federal de Contribuyentes de la razón social del establecimiento que maquiló
el producto tal y como aparece en la cédula fiscal.
|
|
Calle
y número
|
Nombre
completo sin abreviaturas de la calle en la que se ubica el domicilio del maquilador.
|
|
Colonia
|
Nombre
completo sin abreviaturas de la colonia en donde se ubica el domicilio del maquilador.
|
|
Delegación
o municipio
|
Nombre
completo sin abreviaturas de la delegación política o municipio en donde se
ubica el domicilio del maquilador.
|
|
Localidad
|
Localidad
en donde se encuentra el domicilio del maquilador.
|
|
Código Postal
|
Número
completo del código postal que corresponda el domicilio del maquilador.
|
|
Entidad Federativa
|
Entidad
Federativa en donde se encuentra el domicilio del maquilador.
|
|
Etapa del proceso de fabricación
|
Escriba
las etapas de fabricación que se maquilaron (Formulación, acondicionamiento,
mezcla, envasado, etc.)
|
|
No. de licencia sanitaria o indicar que
presentó aviso de funcionamiento
|
El
número de licencia sanitaria (sólo para medicamentos) o indicar que presentó
Aviso de Funcionamiento.
|
|
Nombre del responsable sanitario
|
Nombre
completo sin abreviaturas del responsable sanitario del maquilador.
|
|
RFC del responsable sanitario o de
operación.
|
RFC
del responsable sanitario o de operación bajo el cual se encuentra registrado
ante la Secretaría de Hacienda y Crédito Público.
|
|
Teléfono(s) y fax
|
Número(s)
telefónico(s) y fax donde se localice el maquilador
del producto.
|
|
Correo electrónico
|
Dirección
del correo electrónico en minúsculas y sin dejar espacios del maquilador o del representante legal o del responsable
sanitario.
|
8.- B). FABRICACION, DISTRIBUCION Y
ALMACENAMIENTO DE PRODUCTOS IMPORTADOS.
|
Nombre del fabricante en el extranjero
|
Nombre
completo sin abreviaturas del fabricante en el extranjero para productos de
importación (persona física) o razón social (personal moral)
|
|
Calle
y número
|
Nombre
completo sin abreviaturas de la calle en la que se ubica el domicilio del
fabricante.
|
|
Colonia
|
Nombre
completo sin abreviaturas de la colonia en donde se ubica el domicilio del
fabricante.
|
|
Delegación
o municipio
|
Nombre
completo sin abreviaturas de la delegación política o municipio en donde se
ubica el domicilio del fabricante.
|
|
Localidad
|
Localidad
en donde se encuentra el domicilio del fabricante.
|
|
Código
postal
|
Número
completo del código postal que corresponda el domicilio del fabricante.
|
|
Entidad
federativa
|
Entidad
federativa en donde se encuentra el domicilio del fabricante.
|
|
Nombre
del proveedor o distribuidor
|
Nombre
completo sin abreviaturas del proveedor o distribuidor (para dispositivos
médicos de importación).
|
|
RFC
|
Registro
Federal de Contribuyentes del proveedor o distribuidor bajo el cual se
encuentra registrado ante la Secretaría de Hacienda y Crédito Público.
|
|
Calle
y número
|
Nombre
completo sin abreviaturas del la calle en la que se ubica el domicilio del
proveedor o distribuidor.
|
|
Colonia
|
Nombre
completo sin abreviaturas de la colonia en donde se ubica el domicilio del
proveedor o distribuidor.
|
|
Delegación
o municipio
|
Nombre
completo sin abreviaturas de la delegación política o municipio en donde se
ubica el domicilio del proveedor o distribuidor.
|
|
Localidad
|
Localidad
en donde se encuentra el domicilio del proveedor o distribuidor.
|
|
Código
Postal
|
Número
completo del código postal que corresponda el domicilio del proveedor o
distribuidor.
|
|
Entidad
Federativa
|
Entidad
federativa en donde se encuentra el domicilio del proveedor o distribuidor.
|
|
Nombre del establecimiento que
acondicionará o almacenará el producto.
|
Nombre
completo sin abreviaturas del establecimiento que acondicionará o almacenará
el producto en México.
|
|
RFC
|
Registro
Federal de Contribuyentes del establecimiento que acondicionará o almacenará
los dispositivos médicos de importación bajo el cual se encuentra registrado
ante la Secretaría de Hacienda y Crédito Público.
|
|
Calle
y número
|
Nombre
completo sin abreviaturas de la calle en la que se ubica el domicilio del
establecimiento que acondicionará o almacenará los dispositivos médicos.
|
|
Colonia
|
Nombre
completo sin abreviaturas de la colonia en donde se ubica el domicilio del
establecimiento que acondicionará o almacenará los dispositivos médicos.
|
|
Delegación
o municipio
|
Nombre
completo sin abreviaturas de la delegación política o municipio en donde se
ubica el domicilio del establecimiento que acondicionará o almacenará los
dispositivos médicos.
|
|
Localidad
|
Localidad
en donde se encuentra el domicilio del establecimiento que acondicionará o
almacenará los dispositivos médicos.
|
|
Código
postal
|
Número
completo del código postal que corresponda el domicilio del establecimiento
que acondicionará o almacenará los dispositivos médicos.
|
|
Entidad
federativa
|
Entidad
federativa en donde se encuentra el domicilio del establecimiento que
acondicionará o almacenará los dispositivos médicos.
|
8. C)
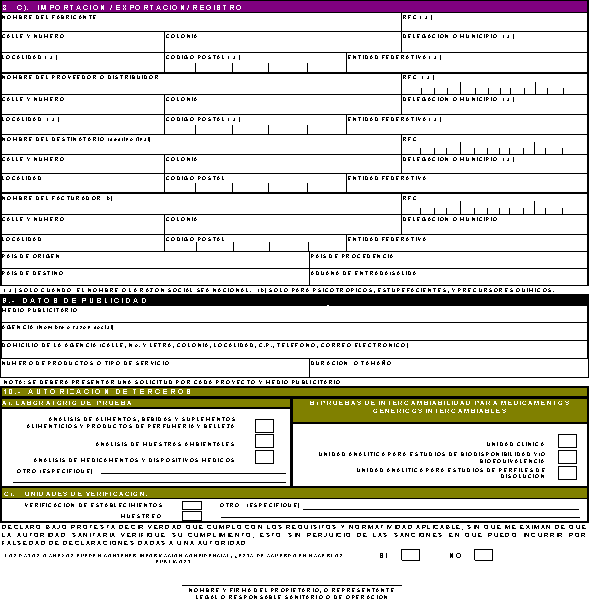
IMPORTACION/EXPORTACION / REGISTRO.
Nombre del fabricante. Nombre completo sin
abreviaturas del fabricante del producto.
RFC Registro
Federal de Contribuyentes del fabricante bajo el cual se encuentra registrado
ante la Secretaría de Hacienda y Crédito Público.
Domicilio Nombre
completo sin abreviaturas del domicilio (Calle, No. y letra) del fabricante.
Nombre del proveedor o
distribuidor Nombre completo sin
abreviaturas del proveedor o distribuidor de producto.
RFC Registro
Federal de Contribuyentes del proveedor o distribuidor bajo el cual se
encuentra registrado ante la Secretaría de Hacienda y Crédito Público.
Domicilio Nombre
completo sin abreviaturas del domicilio (calle, No., y letra) del proveedor o
distribuidor.
Nombre
del Destinatario (destino final) Nombre completo sin abreviaturas
del destinatario del producto.
RFC Registro
Federal de Contribuyentes del destinatario bajo el cual se encuentra registrado
ante la Secretaría de Hacienda y Crédito Público.
Domicilio Nombre
completo sin abreviaturas del domicilio (calle, No. y letra) del destinatario
del producto.
Nombre del facturador. Nombre
completo y sin abreviaturas del facturador. Sólo para
psicotrópicos, estupefacientes y precursores químicos.
RFC Registro
Federal de Contribuyentes del facturador bajo el cual
se encuentra registrado ante la Secretaría de Hacienda y Crédito Público.
Domicilio Nombre
completo sin abreviaturas del domicilio (calle, No. y letra) del facturador.
País de origen Indicar
el nombre del país donde se fabricó el producto (sólo en importación).
País de procedencia Indicar el nombre
del país de donde procede el producto (sólo en importación)
País de destino Indicar el
nombre del país de destino para exportación.
Aduana(s) de entrada /
salida Indicar la aduana de
entrada o salida del producto (importación/exportación).
9. DATOS
DE PUBLICIDAD.
|
Medio
publicitario
|
Cine,
televisión, radio, internet, medios digitales,
otras tecnologías o medio impreso específicos.
|
|
Agencia
|
Nombre
o razón social de la agencia publicitaria quien realizó el proyecto de
publicidad.
|
|
Domicilio
de la agencia
|
Domicilio
(calle, No. y letra, localidad, C.P., teléfono y
correo electrónico) completo y sin abreviaturas de la agencia publicitaria
(sólo cuando aplique).
|
|
Número de productos o tipo de servicio
|
Especificar
en el cuadro número de productos o el tipo de servicio (procedimientos de
embellecimiento, prestación de servicios de salud, etc.), la cantidad de
productos diferentes que aparecen en el anuncio del mismo medio publicitario.
|
|
Duración
o tamaño
|
La
duración se refiere al tiempo que durará el impacto (cine, radio o TV), mas
no el tiempo que durará la campaña al aire. El tamaño se refiere al impreso:
tamaño mayor (impreso mayor de 1 m2); tamaño menor (impreso menor
de 1 m2).
|
10. TERCEROS AUTORIZADOS
Marque con una “X” el tipo
de servicio que pretende prestar.
Otro (Especifique) Anotar el área
en que solicita la autorización
|
Nombre y firma del propietario, representante legal o
responsable sanitario/operación.
|
Nombre completo sin abreviaturas y firma autógrafa
del responsable del trámite.
|
LISTADO DE ANEXOS PARA EL FORMATO DE SOLICITUDES
Las solicitudes deberán presentarse en su
respectivo formato debidamente requisitado y anexando
la documentación correspondiente y presentando el original para cotejo y dos
copias del comprobante de pago; (el original se queda en el Centro Integral de
Servicios como requisito indispensable para el ingreso del trámite):
1. PARA
LOS CASOS DE SOLICITUD DE PERMISO.
1.1 PERMISO SANITARIO PARA VENTA O DISTRIBUCION
DE PRODUCTOS BIOLOGICOS Y HEMODERIVADOS.
1.1.1. Productos antibióticos:
1.1.1.1 No se
presentan documentos anexos
1.1.2. Productos biológicos:
1.1.2.1 Licencia
Sanitaria.
1.1.2.2 Aviso de
Responsable sanitario.
1.1.2.3
Certificado de no presencia de VIH ni Hepatitis.
1.1.2.4 Protocolo
de fabricación o los resultados analíticos emitidos por la Secretaría o por un
Tercero Autorizado de acuerdo con la norma correspondiente.
1.2 PERMISO DE RESPONSABLE DE LA
OPERACION Y FUNCIONAMIENTO DE ESTABLECIMIENTOS DE DIAGNOSTICO MEDICO CON RAYOS
X.
1.2.1 En
caso de expedición:
1.2.1.1 Dos
fotografías tamaño infantil.
1.2.2 En
caso de modificación:
1.2.2.1 Permiso
Sanitario vigente (original).
1.2.2.1.1 Por
cambio de horario.
1.2.2.1.1.1
Original del permiso vigente del responsable de la operación y funcionamiento
de establecimientos de diagnóstico médico con rayos X.
1.2.2.1.1.2
Certificado o recertificación urgente de especialidad
emitida por el Consejo mexicano de Radiología e Imagen, A.C.
1.3. PERMISO
SANITARIO PARA ASESOR ESPECIALIZADO EN SEGURIDAD RADIOLOGICA PARA
ESTABLECIMIENTOS DE DIAGNOSTICO MEDICO CON RAYOS X (EXPEDICION).
1.3.1 Para expedición:
1.3.1.1 Documentos del responsable medico:
1.3.1.2 Diploma de especialidad en seguridad
radiológica expedida por una institución reconocida.
1.3.1.3 Manual de Procedimiento
1.3.1.4 Documentos del personal soporte:
1.3.1.5 Certificado de estudios.
1.3.1.6 Diploma de curso en seguridad radiológica.
1.3.1.7 Certificados de calibración de los equipos a
utilizar en el servicio.
1.3.1.8 Cédula de información técnica, conteniendo
los siguientes datos:
1.3.1.8.1
Identificación del sector a que pertenece.
1.3.1.8.2 Fecha de
llenado.
1.3.1.9 Datos del
personal soporte
1.3.1.9.1 Nombre
1.3.1.9.2 Nivel
académico:
1.3.1.9.2.1 Máximo
1.3.1.9.2.2 Area.
1.3.1.9.2.3
Institución.
1.3.1.10
Capacitación en seguridad radiológica:
1.3.1.10.1
Institución.
1.3.1.10.2 Numero
de autorización del curso.
1.3.1.10.3 Fecha
de última capacitación.
1.3.1.11
Experiencia en seguridad radiológica.
1.3.1.12
Información del equipo para evaluar radiografía convencional, fluoroscopia,
tomografía, mamografía o panorámica dental:
1.3.1.13 Pruebas a
realizar a parámetros a medir en el servicio que se puede prestar.
1.3.1.14
Descripción del equipo para proporcionar el servicio:
1.3.1.14.1 Marca.
1.3.1.14.2 Modelo.
1.3.1.14.3 Número
de Serie.
1.3.1.14.4 Ultima
calibración:
1.3.1.15 Nombre
del laboratorio.
1.3.1.16 Número de
autorización del laboratorio.
1.3.1.17 Fecha de
la última calibración.
1.3.2 Para modificación.
1.3.2.1 Permiso de
asesor especializado en seguridad radiológica (original).
1.3.2.2
Actualización de la cédula de información técnica.
1.3.2.3
Certificados de Calibración de los equipos a utilizar en los servicios.
1.3.2.4 En caso de cambio de responsable del
servicio:
1.3.2.4.1 Diploma
de especialidad en seguridad radiológica expedido por una institución
reconocida.
1.4 PERMISO DE ADQUISICION EN PLAZA DE
MATERIAS PRIMAS O MEDICAMENTOS QUE SEAN O CONTENGAN ESTUPEFACIENTES O
PSICOTROPICOS.
1.4.1 No se
requieren documentos anexos.
1.5 PERMISO
DE LIBERACION Y/O MUESTREO DE MATERIAS PRIMAS, FARMACOS Y MEDICAMENTOS QUE SEAN
O CONTENGAN ESTUPEFACIENTES O PSICOTROPICOS.
1.5.1 Original y
copia del certificado de análisis realizado por un laboratorio de la SSA, por
el propio laboratorio o por un tercero autorizado.
1.6 Permiso
publicitario de INSUMOS PARA LA SALUD, productos o servicios.
1.6.1 Para todos los casos:
1.6.1.1 Solicitud
debidamente llenada.
1.6.1.2 Proyecto
publicitario en dos tantos.
1.6.1.3 Pago de
derechos.
1.6.1.4
Documentación que dé sustento a las afirmaciones hechas en la publicidad.
1.6.2 Para el caso de medicamentos y remedios
herbolarios:
1.6.2.1 Número de
licencia sanitaria o aviso de funcionamiento, en su caso.
1.6.3 Para el caso de Insumos para la salud
(prótesis, órtesis, productos higiénicos, etc.):
1.6.3.1
Autorización sanitaria (registro) y su marbete autorizado.
1.6.4 Para el caso de plaguicidas, nutrientes
vegetales y sustancias tóxicas:
1.6.4.1 No se
presentan documentos anexos
1.6.5 Bebidas alcohólicas, tabaco y
suplementos alimenticios:
1.6.5.1 Número de
licencia sanitaria o aviso de funcionamiento, en su caso.
1.6.6 Para el caso de servicios de salud:
1.6.6.1 Número de
licencia sanitaria o aviso de funcionamiento, en su caso.
1.7 PERMISO SANITARIO DE IMPORTACION DE
INSUMOS PARA LA SALUD.
1.7.1 Para importación de medicamentos que no
sean o contengan estupefacientes o psicotrópicos, que no cuenten con registro
sanitario destinados a:
1.7.1.1 Investigación:
1.7.1.1.1
Número de licencia sanitaria
1.7.1.1.2
Número de oficio de aprobación del protocolo de investigación autorizado por la
Secretaría de Salud. Sólo en el caso de investigaciones en seres humanos.
1.7.1.2 Maquila:
1.7.1.2.1
Copia de autorización de maquila expedida por la Secretaría de Economía y
listas anexas o listas de ampliación de maquila que amparen los productos a
importar.
1.7.1.3 Tratamientos especiales en
enfermedades de baja incidencia con repercusión social:
1.7.1.3.1
Cédula profesional del médico
1.7.1.4 Uso personal:
1.7.1.4.1 Receta
médica, vigente, que incluya número de cédula profesional y que ampare el
producto y la cantidad. (no se requiere en caso de insumos de libre venta).
1.7.1.5 Donación:
1.7.1.5.1 Carta de
donación y carta de aceptación de la donación que incluya compromiso de no
comercialización.
1.7.1.6 En el caso de establecimientos de
servicios de salud públicas, sociales o privadas, además:
1.7.1.6.1
Número de la Licencia Sanitaria o Aviso de funcionamiento, en su caso.
1.7.1.7 En caso de pruebas de laboratorio:
1.7.1.7.1
Número de Licencia Sanitaria vigente, en su caso.
1.7.2 Para importar productos farmoquímicos como materia prima:
1.7.2.1
Las fracciones
previstas en el artículo 1 apartado B del Acuerdo del 21 de enero de 1998 y que
se refieren a las siguientes sustancias Acido d-2-(6-metoxi -s-naftil) propiónico ( naproxen), y su sal
de sodio; Ester dimetílico del ácido 1,4-dihidro-2,6-dimetil-4-(2-nitrofenil)-3,5-piridín dicarboxílico (Nifedipina); Acido 4-cloro -N-(2-furilmetil)-5-sulfamoilantranilato ( Furosemida)
; Vitamina B12 o cobalaminas; Bencil
penicilina sódica; Bencil penicilina; procaínica; N,N' Dibenciletilendiamino bis (Bencilpenicilina);
Ampicilina; y sus sales; Amikacina
y sus sales; 3-(2,6-Dicolorofenil)-5-metil-4-isoxazolil penicilina
sódica, se solicitará:
1.7.2.2
Número de la Licencia Sanitaria vigente.
1.7.2.3
Número de Aviso de funcionamiento, sólo para venta o distribución
1.7.2.4
Aviso de responsable
1.7.2.5 Original (para
cotejo) y copia del certificado o escrito aclaratorio expedido por la autoridad
sanitaria del país de origen, que compruebe que el farmoquímico
a importar cumple con las buenas prácticas de fabricación, vigente.
1.7.2.6
Certificado de análisis que avale el lote del producto a importar en original
(para cotejo) y copia, vigente expedido por el fabricante del farmoquímico a importar que compruebe que cumple con las
especificaciones de calidad establecidas en la Farmacopea de los Estados Unidos
Mexicanos, vigente.
1.7.3 Para importación de materias primas, o
para medicamentos que cuenten con registro sanitario:
1.7.3.1
Número de la Licencia Sanitaria vigente.
1.7.3.2
Número de Aviso de funcionamiento, sólo para venta o distribución
1.7.3.3
Aviso de responsable.
1.7.3.4
Número de registro sanitario y sus modificaciones y/o proyectos de Marbete, en
su caso.
(Sólo para los medicamentos para los que requieran registro sanitario)
1.7.3.5
En el caso de farmoquímicos para la elaboración de
medicamentos con registro sanitario, además, los requisitos establecidos en el
punto 1.7.2.5 y 1.7.2.6
1.7.4 Para la importación de insumos que
contengan hemoderivados.
1.7.4.1 Número de la Licencia Sanitaria
vigente.
1.7.4.2 Certificado de análisis del país de origen con leyenda que
compruebe donadores negativos al VIH-1, VIH-2, Hepatitis B y C, avalado por la
autoridad sanitaria del país de origen, vigente.
1.7.5 Para importación de remedios herbolarios:
1.7.5.1
Número de Aviso de funcionamiento.
1.7.5.2
Número de Aviso de responsable
1.7.5.3
Número de clave alfanumérica y sus modificaciones, en su caso y/o proyectos de
marbete autorizados.
1.7.6 Para importar válvulas cardíacas prótesis
internas, marcapasos, prótesis, reactivos de diagnóstico con isótopos
radiactivos, con registro sanitario o insumos usados:
1.7.6.1 Aviso de
funcionamiento.
1.7.6.2 Número de registro sanitario y sus
modificaciones y/o proyectos de marbete, en su caso.
1.7.6.3 Para equipos usados, factura certificada ante
notario público que indique que el equipo es usado.
1.7.6.4 En caso de aparatos de rayos X usados, copia del
certificado del cumplimiento de la NOM-158-SSA-1-1996, expedida por el
fabricante en idioma español o por un asesor especializado en seguridad
radiológica.
1.7.6.5
Tratándose de fuentes de radiación, licencia sanitaria expedida en forma
coordinada por la Comisión Nacional de Seguridad Nuclear y Salvaguardias.
1.7.7 Para importar dispositivos médicos sin
registro o en fase de experimentación para:
1.7.7.1 Maquila:
1.7.7.1.1
Copia de autorización de maquila expedida por la Secretaría de Economía y
listas anexas o listas de ampliación de maquila que amparen los productos a
importar.
1.7.7.2 Uso personal:
1.7.7.2.1
Receta médica vigente, que incluya número de cédula profesional y que ampare el
producto y la cantidad. ( no se requiere en caso de insumos de libre venta)
1.7.7.3 Médicos:
1.7.7.3.1
Cédula profesional del médico.
1.7.7.3.2
Tratándose de fuentes de radiación licencia sanitaria expedida en forma coordinada
por la Comisión Nacional de Seguridad Nuclear y Salvaguardias.
1.7.7.3.3
En caso de equipos usados:
1.7.7.3.3.1 Factura certificada que indique que
el equipo es usado
1.7.7.3.3.2
En el caso de aparato de rayos X, copia del certificado del cumplimiento de la
NOM-158-SSA-1-1996, expedida por el fabricante en idioma español o por un
asesor especializado en seguridad radiológica.
1.7.7.3.4 Para establecimientos de servicios de
salud públicas, sociales o privadas, además:
1.7.7.3.4.1
Copia de la Licencia Sanitaria vigente o aviso de funcionamiento, en su caso.
1.7.7.4 Investigación.
1.7.7.4.1
Número de aviso de funcionamiento
1.7.7.4.2
Número de oficio de aprobación del protocolo de investigación autorizado por la
Secretaría de Salud. Sólo en el caso de investigaciones en seres humanos.
1.7.7.5 Donación:
1.7.7.5.1
Carta de donación y carta de aceptación que incluya compromiso de no
comercialización.
1.7.7.5.2 En el caso de establecimientos de
servicios de salud públicas, sociales o privadas, además:
1.7.7.5.2.1
Número de la Licencia Sanitaria, o aviso de funcionamiento, en su caso.
1.7.7.5.3 Tratándose de fuentes de radiación, licencia
sanitaria expedida en forma coordinada por la Comisión Nacional de Seguridad
Nuclear y Salvaguardias.
1.7.7.5.4 En caso de equipos usados:
1.7.7.5.4.1
Factura certificada que indique que el equipo es usado
1.7.7.5.4.2 En caso de aparatos
de rayos X, copia del certificado del cumplimiento de la
NOM-158-SSA-1-1996, expedida por el fabricante en idioma español o por un asesor especializado
en seguridad radiológica.
1.7.8 Retorno de insumos para la salud.
1.7.8.1 Copia del
pedimento de exportación.
1.7.8.2 Factura de
exportación que ampare el producto que se exportó, donde se especifique la
cantidad, el nombre y domicilio completo del destinatario.
1.7.8.3 Carta de
rechazo emitida por la autoridad sanitaria del país al que se exportó, donde se
indique el motivo del rechazo; en caso de no ser el rechazo por la autoridad,
un escrito en hoja membretada de la empresa donde se
indique el motivo del retorno.
1.7.8.4 Carta del
importador donde indique cantidad, destino y uso del producto, lote y fecha de
caducidad en su caso, en papel membretado de la
empresa.
1.8 PERMISO DE IMPORTACION O EXPORTACION DE
ESTUPEFACIENTES O PSICOTROPICOS (MATERIAS PRIMAS, FARMACOS O MEDICAMENTOS);
1.8.1 Para el caso exportaciones de
Psicotrópicos, Estupefacientes y Precursores Químicos:
1.8.1.1 Permiso de
importación emitido por la autoridad sanitaria del país de destino, o documento
actualizado indicando que no requiere permiso (en el caso de exportaciones).
1.9 permiso sanitario previo de IMPORTACION DE
PRODUCTOS Y SERVICIOS.
1.9.1 Expedición:
1.9.1.1 Primera opción:
1.9.1.1.1 Original
de constancia sanitaria o certificado sanitario
1.9.1.1.2 Etiqueta
de origen. (original)
1.9.1.1.3 Etiqueta
con la que se comercializará en México.
1.9.1.2 Segunda opción:
1.9.1.2.1 Original
y copia del certificado de libre venta.
1.9.1.2.2 Análisis
fisicoquímico, microbiológico o específico, según sea el caso.
1.9.1.2.2.1 El
análisis específico a que se refiere el punto anterior deberá ser, según
corresponda:
1.9.1.2.2.1.1 Para
productos comestibles de la pesca en mares contaminados (Mar del Norte):
análisis de determinación de metales pesados.
1.9.1.2.2.1.2 Para
productos comestibles frescos y congelados de la pesca, procedentes de Centro,
Sudamérica y países asiáticos y en donde se presenta la infección con Vibrio Cholerae:
análisis o determinación de Vibrio Cholerae.
1.9.1.2.2.1.3 Para
aceites y grasas comestibles: análisis o determinación de Indice
de Peróxido.
1.9.1.2.2.1.4 Para
productos alimenticios provenientes de países o zonas afectadas por accidentes
nucleares, particularmente, Europa y Asia: certificado que señale un máximo de
50 bequereles de contaminación radiactiva
1.9.1.2.3 Etiqueta
de origen. (original)
1.9.1.2.4 Etiqueta
con la que se comercializará en México.
1.9.2 Retorno de Productos y Servicios:
1.9.2.1 Copia del
pedimento de exportación.
1.9.2.2 Factura de
exportación que ampare el producto que se exportó, donde se especifique la
cantidad, el nombre y domicilio completo del destinatario.
1.9.2.3 Carta de
rechazo emitida por la autoridad sanitaria del país al que se exportó, donde se
indique el motivo del rechazo; en caso de no ser el rechazo por la autoridad un
escrito en hoja membretada de la empresa donde se
indique el motivo del retorno.
1.9.2.4 Carta del
importador donde indique cantidad, destino y uso del producto, lote y fecha de
caducidad en su caso, en papel membretado de la
empresa.
1.9.2.5 Etiquetas
con las que comercializará en México, de ser el caso
1.9.3 PARA PERMISO SANITARIO PREVIO DE
IMPORTACION EN LA MODALIDAD DE MUESTRAS O CONSUMO PERSONAL:
1.9.3.1 Factura o
recibo que indique muestras sin valor comercial, o guía aérea, marítima o
terrestre que ampare los productos a importar.
1.9.3.2 Carta que
indique el uso que le dará al producto.
2. PARA LOS CASOS DE SOLICITUD DE LICENCIA
SANITARIA.
2.1 LICENCIA SANITARIA PARA ESTABLECIMIENTOS
DE INSUMOS PARA LA SALUD.
2.1.1. Por alta de la Licencia Sanitaria:
2.1.1.1 Registro
federal de contribuyentes.
2.1.2 Por cambio de domicilio del
establecimiento:
2.1.2.1 Original
de la Licencia Sanitaria.
2.1.3 Por modificación por fabricación de
nuevas líneas de producción:
2.1.3.1 Original de
la licencia sanitaria.
2.2 LICENCIA SANITARIA PARA SERVICIOS URBANOS
DE FUMIGACION, DESINFECCION Y CONTROL DE PLAGAS.
2.2.1 Por alta de la Licencia Sanitaria:
2.2.1.1 Examen de colinesterasa en sangre del personal aplicador
(original).
2.2.1.2 Croquis del
local, en donde se especifiquen las áreas con que cuenta para desarrollar las
actividades propias del giro solicitado (original)
2.2.1.3 Manual de
seguridad sobre procedimientos de aplicación, que incluya las medidas de
seguridad a tomar en cuenta para personal aplicador y
usuario del servicio antes, durante y después de cada aplicación. Este debe ser
por tipo de producto empleado (original)
2.2.1.4 Relación
de plaguicidas que se pretenden utilizar detallando:
2.2.1.4.1 Nombre
comercial
2.2.1.4.2 Número de
registro vigente ante la Comisión Intersecretarial para el Control del Proceso
y Uso de Plaguicidas, Fertilizantes y Sustancias Tóxicas que se utilizan.
2.2.1.4.3
Inventario del equipo (cantidad y características) de aplicación que se
utilizará en los servicios que realiza la empresa.
2.2.1.4.4 Relación
de plagas que se pretenden controlar.
2.3 LICENCIA SANITARIA PARA ESTABLECIMIENTOS
QUE FABRICAN SUSTANCIAS TOXICAS O PELIGROSAS PARA LA SALUD
2.3.1 Por alta de la Licencia Sanitaria:
2.3.1.1 Plano
general del establecimiento donde se indiquen las diferentes áreas, así como el
croquis de localización de éstas.
2.3.1.2 Programa
de capacitación y difusión a los trabajadores.
2.3.1.3 Hoja de
datos de seguridad de las sustancias tóxicas o peligrosas que se manejan en el
establecimiento.
2.3.1.4 Programa
de vigilancia a la salud de los trabajadores que manejan sustancias tóxicas o
peligrosas.
2.3.1.5 Lista de
las medidas de seguridad que se aplican en el establecimiento.
2.3.1.6 Lista del
equipo para el control de contaminantes.
2.3.1.7 Lista del
equipo contra incendios.
2.3.1.8 Lista de
las construcciones especiales (sistemas de aspersión, detectores de humos,
alarmas de detección de fugas, sistemas de capacitación de humos y vapores).
2.3.1.9 Cédula de
información técnica de establecimientos.
2.3.1.10
Descripción del proceso industrial, con su diagrama de flujo.
2.3.1.11
Características de maquinaria y equipo por línea de producción.
2.3.1.12
Inventario de materias primas:
2.3.1.12.1
Número de CAS.
2.3.1.12.2
Nombre común.
2.3.1.12.3
Capacidad y tipo de envase.
2.3.1.12.4
Producción mensual.
2.3.1.13
Productos:
2.3.1.13.1
Nombre común.
2.3.1.13.2
Tipo de envase y capacidad.
2.3.1.13.3
Producción mensual.
2.3.1.14
Lista de los productos que requieren de registro único ante la Comisión
Intersecretarial para el Control del Proceso y Uso de Plaguicidas,
Fertilizantes y Sustancias Tóxicas:
2.3.1.14.1
Nombre comercial.
2.3.1.14.2
Nombre común.
2.3.1.14.3
Número de registro.
2.3.1.14.4
Fecha de expedición.
2.3.1.14.5
Vencimiento.
2.3.1.15
Inventario de sustancias peligrosas que generan residuos industriales:
2.3.1.15.1
Número de CAS.
2.3.1.15.2
Origen y destino de la sustancia.
2.3.1.15.3
Nombre común.
2.3.1.15.4
Materia prima.
2.3.1.15.5
Producto.
2.3.1.15.6
Código CRETIB.
2.3.1.15.7
Sólidos, líquidos, lodos y otros.
2.3.1.15.8
Tratamiento.
2.3.1.15.9
Disposición final.
2.3.1.16
Residuos Industriales:
2.3.1.16.1
Describir las características de los residuos industriales.
2.3.1.16.2
Cantidades, promedio diario.
2.3.1.16.3
Describir los tratamientos para descarga o disposición final.
2.3.1.16.4
Periodicidad de las descargas y disposiciones.
2.3.1.16.5
Inventario del equipo de protección personal por área y proceso.
2.3.1.16.6
Inventario del equipo de protección para el desarrollo de actividades
especiales en las que se manejen productos de alta toxicidad y peligrosidad.
2.4 LICENCIA SANITARIA PARA ESTABLECIMIENTOS
QUE FABRICAN, FORMULAN, MEZCLAN O ENVASAN PLAGUICIDAS Y NUTRIENTES VEGETALES.
2.4.1 Por alta de la Licencia Sanitaria:
2.4.1.1
Plano general del establecimiento donde se indiquen las diferentes áreas, así
como el croquis de localización de éstas.
2.4.1.2
Programa de capacitación y difusión a los trabajadores.
2.4.1.3
Hoja de datos de seguridad de las sustancias tóxicas o peligrosas que se
manejan en el establecimiento.
2.4.1.4
Programa de vigilancia a la salud de los trabajadores que manejan sustancias
tóxicas o peligrosas.
2.4.1.5
Lista de las medidas de seguridad que se aplican en el establecimiento.
2.4.1.6
Lista del equipo para el control de contaminantes.
2.4.1.7
Lista del equipo contra incendios.
2.4.1.8
Lista de las construcciones especiales (sistemas de aspersión, detectores de
humos, alarmas de detección de fugas, sistemas de capacitación de humos y
vapores).
2.4.1.9
Cédula de información técnica de establecimientos:
2.4.1.9.1
Descripción del proceso industrial, con su diagrama de flujo.
2.4.1.9.2
Características de maquinaria y equipo por línea de producción.
2.4.1.9.3
Inventario de materias primas:
2.4.1.9.3.1
Número de CAS.
2.4.1.9.3.2
Nombre común.
2.4.1.9.3.3
Capacidad y tipo de envase.
2.4.1.9.3.4
Producción mensual.
2.4.1.9.4
Productos:
2.4.1.9.4.1
Nombre común.
2.4.1.9.4.2
Tipo de envase y capacidad.
2.4.1.9.4.3
Producción mensual.
2.4.1.9.4.4
Lista de los productos que requieren de registro único ante la Comisión
Intersecretarial para el Control del Proceso y Uso de Plaguicidas,
Fertilizantes y Sustancias Tóxicas:
2.4.1.9.4.4.1
Nombre comercial.
2.4.1.9.4.4.2
Nombre común.
2.4.1.9.4.4.3
Número de registro.
2.4.1.9.4.4.4
Fecha de expedición
y Vencimiento del registro.
2.4.1.9.5
Inventario de sustancias peligrosas que generan residuos industriales:
2.4.1.9.5.1
Número de CAS.
2.4.1.9.5.2
Origen y destino de la sustancia.
2.4.1.9.5.3
Nombre común.
2.4.1.9.5.4
Materia prima.
2.4.1.9.5.5
Producto.
2.4.1.9.5.6
Código CRETIB.
2.4.1.9.5.7
Sólidos, líquidos, lodos y otros.
2.4.1.9.5.8
Disposición final.
2.4.1.9.6
Residuos Industriales:
2.4.1.9.6.1
Describir las características de los residuos industriales.
2.4.1.9.6.2
Cantidades, promedio diario.
2.4.1.9.6.3
Describir los tratamientos para descarga o disposición final.
2.4.1.9.6.4
Periodicidad de las descargas y disposiciones.
2.4.1.9.7
Inventario del equipo de protección personal por área y proceso.
2.4.1.9.8
Inventario del equipo de protección para el desarrollo de actividades
especiales en las que se manejen productos de alta toxicidad y peligrosidad.
2.4.2 Por modificación a las Instalaciones
cuando impliquen nuevos sistemas de seguridad.
2.4.2.1
Planos y memorias descriptivas
2.4.2.2
Cédula de información técnica
2.4.2.3
Lista de las medidas de seguridad
2.4.2.4
Lista de equipo para el control de contaminantes.
2.4.2.5
Lista de equipo contra incendio
2.4.2.6
Lista de
construcciones especiales.
2.5 LICENCIA SANITARIA PARA ESTABLECIMIENTOS
DE DIAGNOSTICO MEDICO CON RAYOS X (NOM- 146-SSA1-1996).
2.5.1 Por alta de la Licencia Sanitaria:
2.5.1.1
Copia simple del Acta Constitutiva del establecimiento o del alta ante la SHCP
(presentando original para cotejo).
2.5.1.2
Copia simple del poder notarial del representante legal (presentando original
para cotejo), en su caso.
2.5.1.3
Memoria analítica de los blindajes y levantamiento de los niveles de radiación
después de la instalación del equipo, con croquis de distribución de áreas del
establecimiento y ubicación de los equipos dentro del mismo, avalada por un
Asesor especializado en seguridad radiológica.
2.5.1.4
Cédula de la información técnica del establecimiento:
2.5.1.4.1
Datos sanitarios.
2.5.1.4.1.1 Código
de identificación.
2.5.1.4.2
Datos del personal ocupacionalmente expuesto:
2.5.1.4.2.1 Nombre
2.5.1.4.2.2
Registro Federal de Contribuyentes.
2.5.1.4.2.3
Puesto.
2.5.1.4.2.4
Horario.
2.5.1.4.2.5
Formación.
2.5.1.4.2.5.1
Nivel académico.
2.5.1.4.2.5.2
Area.
2.5.1.4.2.6
Capacitación.
2.5.1.4.2.6.1
Fecha del último curso.
2.5.1.4.2.6.2
Institución.
2.5.1.4.3 Equipos.
2.5.1.4.3.1
Localización.
2.5.1.4.3.2 Fecha
de instalación.
2.5.1.4.3.3 Marca.
2.5.1.4.3.4
Corriente.
2.5.1.4.3.5 Modelo
del generador.
2.5.1.4.3.6 Modelo
del tubo de rayos X.
2.5.1.4.3.7
Aplicación.
2.5.1.4.3.8 Uso.
2.5.1.4.3.9 Kilovoltaje máximo.
2.5.1.4.3.10 Miliamperaje máximo.
2.5.1.4.4 Sistema
de revelado:
2.5.1.4.4.1 Marca.
2.5.1.4.4.2
Modelo.
2.5.1.4.4.3 Número
de serie.
2.5.1.4.5
Dispositivos para la protección radiológica de pacientes y de personal ocupacionalmente expuesto.
2.5.1.4.6
Manuales:
2.5.1.4.6.1
Procedimientos técnicos.
2.5.1.4.6.2
Protección y seguridad radiológica.
2.5.2 Por modificación de aplicaciones
(equipo) en establecimientos de diagnóstico médico con rayos X.
2.5.2.1 Memoria
analítica actualizada y levantamiento de niveles de radiación después de la
instalación del equipo avalada por un asesor especializado en seguridad
radiológica con croquis de distribución de áreas del establecimiento y
ubicación de los equipos dentro del mismo.
3. PARA LOS CASOS DE SOLICITUD DE REGISTRO.
3.1 Solicitud de
registro sanitario de dispositivos mEdicos.
3.1.1 Para productos de fabricación nacional y fabricados por otro
establecimiento (Maquila)
3.1.1.1
Información técnica y científica para demostrar que el insumo reúne las
características de seguridad y eficacia.
3.1.1.2 Proyecto
de etiqueta en idioma español, en los términos de la norma oficial mexicana
correspondiente.
3.1.1.3
Instructivo, si procede, para su uso o manual de operación en idioma español.
3.1.1.4
Descripción general del proceso de fabricación que se lleva a cabo para obtener
el producto.
3.1.1.5
Descripción de la estructura, materiales, parte y funciones, en su caso.
3.1.1.6 Constancia
de buenas prácticas de fabricación.
3.1.1.7 Pruebas de
laboratorio para verificar las especificaciones del insumo.
3.1.1.8
Referencias bibliográficas, en su caso.
3.1.1.9 Convenio
de maquila.
3.1.1.10 Los demás
que establezca la SSA de las Normas Oficiales Mexicanas correspondientes.
3.1.2 Para productos de Importación:
3.1.2.1
Información técnica y científica para demostrar que el insumo reúne las
características de seguridad y eficacia.
3.1.2.2 Proyecto
de etiqueta en idioma español, en los términos de la norma oficial mexicana
correspondiente.
3.1.2.3
Instructivo, si procede, para su uso o manual de operación en idioma español.
3.1.2.4 Descripción
general del proceso de fabricación que se lleva a cabo para obtener el
producto.
3.1.2.5
Descripción de la estructura, materiales, parte y funciones, del dispositivo
médico en su caso.
3.1.2.6 Pruebas de
laboratorio para verificar las especificaciones del insumo.
3.1.2.7
Referencias bibliográficas.
3.1.2.8 Los demás
que establezca la SSA de las Normas Oficiales Mexicanas correspondientes.
3.1.2.9 Además de los documentos anteriores
deberán incluirse los siguientes:
3.1.2.9.1Certificado
de libre venta o equivalente, expedido por la autoridad sanitaria del país de
origen.
3.1.2.9.2 Carta de
representación del fabricante, autenticada por el procedimiento legal que
exista en el país de origen, en español o en otro idioma, con su respectiva traducción
al español por perito traductor, si el producto no es fabricado por la casa
matriz o fábrica o laboratorio que solicita el registro sanitario en México.
3.1.2.9.3
Certificado de buenas prácticas de fabricación expedido por la autoridad
sanitaria del país de origen.
3.1.2.9.4 Copia
del certificado de análisis emitido por la empresa que elabora el producto, en
hoja membretada y debidamente firmado por el
responsable de control de calidad.
3.1.2.9.5 Copia
del aviso de funcionamiento de establecimientos de insumos para la salud.
3.1.2.9.6 Copia de
responsable sanitario.
3.2. SOLICITUD DE MODIFICACIONES A LAS
CONDICIONES DEL REGISTRO:
3.2.1 Para distribuidores del fabricante en el
extranjero:
3.2.1.1
Información técnica, científica y jurídica (carta de representación del
fabricante o actualización de la razón social del mismo, en su caso) que
justifique la modificación.
3.2.1.2 Proyecto
de etiqueta o contraetiqueta, instructivo de uso, en
su caso, o manual de operación en idioma español.
3.2.1.3 Carta de
representación autenticada del fabricante por el procedimiento legal que exista
en el país de origen, en idioma español o en otro idioma, con su respectiva
traducción, realizada por perito traductor.
3.2.1 Para insumos con presentación exclusiva
para instituciones públicas de salud o de seguridad social:
3.2.1.1
Información técnica, científica y jurídica que justifique la modificación.
3.2.1.2 Proyecto
de etiqueta o contraetiqueta, instructivo de uso, en
su caso, o manual de operación en idioma español.
3.2.1.3 Copia de
la descripción y clave correspondiente en el Cuadro Básico del sector salud o
en el Catálogo de dispositivos médicos.
3.2.1.4 Para fuentes de radiación:
3.2.1.4.1
Información técnica, científica y jurídica que justifique la modificación.
3.2.1.4.2 Proyecto
de etiqueta o contraetiqueta, instructivo de uso, en
su caso, o manual de operación en idioma español.
3.2.1.5 Por cesión de derechos:
3.2.1.5.1
Información técnica, científica y jurídica que justifique la modificación.
3.2.1.5.2
Proyecto(s) de etiqueta o contraetiqueta, instructivo
de uso, en su caso, o manual de operación en idioma español.
3.2.1.5.3 Además
de los documentos anteriores deberán incluirse los siguientes:
3.2.1.5.4 Copia
certificada del contrato donde conste la cesión firmado por ambas partes.
3.2.1.6 Por maquila:
3.2.1.6.1
Información técnica, científica y jurídica que justifique su modificación.
3.2.1.6.2
Proyecto(s) de etiqueta o contraetiqueta, instructivo
de uso, en su caso, o manual de operación en idioma español.
3.2.1.7 Para modificaciones de tipo técnico:
3.2.1.7.1.1
Información técnica, científica y jurídica que justifique su modificación.
3.2.1.7.1.2
Proyecto(s) de etiqueta o contraetiqueta, instructivo
de uso, en su caso, o manual de operación en idioma español.
3.2.1.8 Para todos los casos de modificación,
además de los documentos anteriores deberán incluirse los siguientes:
3.2.1.8.1 Copia
del aviso de funcionamiento de establecimientos de insumos para la salud.
3.2.1.8.2 Copia
del registro sanitario y las modificaciones, en su caso, así como sus anexos
correspondientes.
3.3 SOLICITUD DE REGISTRO SANITARIO DE
MEDICAMENTOS.
3.3.1 Para medicamentos alopáticos, vacunas y
hemoderivados:
3.3.1.1 La información técnica y científica que
demuestre:
3.3.1.1.1
La estabilidad del producto terminado conforme a las Normas Oficiales Mexicanas
correspondientes a las normas del país de origen.
3.3.1.1.2
La eficacia terapéutica y seguridad de acuerdo con la información científica
publicada en revistas de prestigio y referencias bibliográficas, en caso de no
haber, Estudios in-Vitro o clínicos que señale la Secretaría.
3.3.1.1.3
La información para prescribir en sus versiones amplia y reducida.
3.3.1.1.4
El proyecto de etiqueta para envases primario y/o secundario conforme a la Norma
Oficial Mexicana correspondiente.
3.3.1.2 La información técnica y científica que
demuestre la identidad y pureza de sus componentes:
3.3.1.2.1 Para las materias primas:
3.3.1.2.1.1
Monografía de la materia prima y sus referencias bibliográficas
3.3.1.2.1.2
Métodos de Control, su validación y referencias bibliográficas. Certificados de
análisis realizados en el laboratorio, espectros o cromatogramas
obtenidos.
3.3.1.2.2 Del producto terminado:
3.3.1.2.2.1
Monografía y sus referencias bibliográficas.
3.3.1.2.2.2
Métodos de Control, su validación y referencias bibliográficas.
3.3.1.2.2.3
Certificados de análisis realizados en el laboratorio, espectros o cromatogramas obtenidos.
3.3.1.2.2.4
Copia de las órdenes de producción de los lotes utilizados para las pruebas de
estabilidad.
3.3.1.2.3 De los materiales de envase:
3.3.1.2.3.1
Descripción y capacidad de los materiales de envase primario y secundario.
3.3.1.2.3.2
Prueba de hermeticidad del producto terminado en el envase primario, resultados
y referencia bibliográfica.
3.3.1.3 Para medicamentos alopáticos, vacunas y
hemoderivados de fabricación extranjera, además de lo anterior:
3.3.1.3.1
Original del certificado de libre venta expedido por la autoridad sanitaria del
país de origen.
3.3.1.3.2
Original del certificado de buenas prácticas de fabricación expedida por la
autoridad correspondiente del país de origen.
3.3.1.3.3
Original de la carta de representación autenticada por el procedimiento legal
que exista en el país de origen, en español o en otro idioma, con su respectiva
traducción al español realizada por perito traductor, cuando el laboratorio que
lo fabrique en el extranjero no sea filial o casa matriz del laboratorio
solicitante del registro sanitario.
3.3.2 Para fórmulas para alimentación enteral especializada:
3.3.2.1
Descripción del producto.
3.3.2.2
Fórmula cuali-cuantitativa (debe ir firmada por el
responsable sanitario).
3.3.2.3
Proyecto de etiqueta con leyendas precautorias y condiciones de manejo,
conservación y almacenamiento.
3.3.2.4
Instructivo de uso (en su caso).
3.3.2.5
Pruebas de estabilidad.
3.3.2.6
Original del certificado de análisis de materias primas y producto terminado,
sus métodos de control y referencias bibliográficas.
3.3.2.7
Especificaciones de producto terminado.
3.3.2.8
Original del certificado de libre venta emitido por la autoridad sanitaria u
organismo competente del país de origen, si el producto es de importación.
3.3.2.9
Original de la carta de representación del producto, en su caso, autenticada
por el procedimiento legal que exista en el país de origen, en español o en
otro idioma, con su respectiva traducción al español realizada por perito
traductor.
3.3.3 Para biomedicamentos:
3.3.3.1
Monografía del biofármaco, composición y fórmula.
3.3.3.2
Origen e historia del banco celular maestro, el gene, la construcción del
sistema de expresión vector. Hospedero para la proteína de interés y la
caracterización relevante del genotipo y fenotipo.
3.3.3.3
Resumen del proceso de fabricación: cepa o línea celular, fermentación,
separación y purificación.
3.3.3.4
Métodos analíticos: físico, químicos y biológicos.
3.3.3.5
La validación del proveedor de acuerdo con buenas prácticas de fabricación, que
el producto cumple con las especificaciones predeterminadas.
3.3.3.6
Monografía del medicamento: forma farmacéutica, especificaciones cualitativas y
cuantitativas.
3.3.3.7
Proceso de fabricación: formulación, llenado y acondicionamiento.
3.3.3.8
Proyectos, en su caso, de etiqueta y del instructivo correspondiente, así como las
especificaciones de los envases primario y secundario.
3.3.4 Para productos herbolarios de
fabricación nacional:
3.3.4.1 La
información técnica y científica que demuestre la identidad y pureza de sus
componentes de acuerdo con lo que establezcan las farmacopeas especiales o, en
su defecto, las fuentes de información científica internacional:
3.3.4.1.1
Descripción del envase primario y secundario.
3.3.4.1.2 Método
de identificación del principio o principios activos.
3.3.4.2 La información técnica y científica
que demuestre la estabilidad del producto terminado.
3.3.4.2.1
Identificación taxonómica de las plantas utilizadas.
3.3.4.3
Indicaciones terapéuticas.
3.3.4.4 Proyectos
de etiqueta.
3.3.4.5
Instructivo para su uso (en su caso).
3.3.4.6
Descripción del proceso de fabricación del medicamento por registrar.
3.3.4.7
Información para prescribir en sus versiones amplia y reducida.
3.3.5 Para productos herbolarios de
fabricación extranjera (además de lo anterior):
3.3.5.1 Copia del
certificado de libre venta expedido por la autoridad competente del país de
origen.
3.3.5.2 Copia de
la carta de representación del fabricante, autenticada por el procedimiento
legal que exista en el país de origen, en español o en otro idioma, con su
respectiva traducción al español por perito traductor, cuando el laboratorio
que lo fabrique en el extranjero no sea filial o casa matriz del laboratorio
solicitante del registro sanitario.
3.3.6 Para productos homeopáticos de
fabricación nacional:
3.3.6.1 La información técnica y científica
que demuestre:
3.3.6.1.1 La
identidad y pureza de sus componentes de acuerdo con lo que establece la
Farmacopea Homeopática de los Estados Unidos Mexicanos y sus suplementos o, en
su defecto, las farmacopeas Homeopáticas de otros países o fuentes de
información científica internacional.
3.3.6.1.2 La
estabilidad del producto terminado conforme a la Norma Oficial Mexicana
correspondiente.
3.3.6.2
Indicaciones Terapéuticas.
3.3.6.3 Proyectos
de etiqueta.
3.3.6.4
Patogénesis de principios activos.
3.3.6.5
Instructivo para su uso, en su caso.
3.3.6.6
Descripción del proceso de fabricación del medicamento.
3.3.6.7 Texto de
la versión amplia y reducida de la información para prescribir en el caso de
los medicamentos a lo que se refieren las fracciones I a IV del artículo 226 de
la Ley General de Salud.
3.3.7 Para productos homeopáticos de
fabricación extranjera (además de lo anterior):
3.3.7.1 Copia del
certificado de libre venta expedido por la autoridad competente del país de
origen.
3.3.7.2 Copia de
la Carta de Representación del fabricante, autenticada por el procedimiento
legal que exista en el país de origen, en español o en otro idioma, con su
respectiva traducción al español por perito traductor, cuando el laboratorio
que lo fabrique en el extranjero no sea filial o casa matriz del laboratorio
solicitante del registro sanitario.
3.3.8 Para medicamentos vitamínicos de
fabricación nacional:
3.3.8.1 Monografía
del producto terminado con métodos de control cualitativo y cuantitativo de
todos los componentes.
3.3.8.2
Condiciones de manejo, conservación y almacenamiento.
3.3.8.3
Descripción del envase primario y secundario y pruebas de toxicidad.
3.3.8.4 Proyectos
de etiqueta con leyendas precautorias.
3.3.8.5
Instructivo de uso, en su caso.
3.3.8.6 Pruebas de
estabilidad, de acuerdo con la Norma Oficial Mexicana.
3.3.8.7 Copia del
certificado de análisis de materia prima y producto terminado, que contenga las
especificaciones físico químicas y microbiológicas.
3.3.8.8
Información para prescribir en sus versiones amplia y reducida.
3.3.9 Para medicamentos vitamínicos de
fabricación extranjera (además de lo anterior):
3.3.9.1 Copia del
certificado de libre venta o equivalente si el producto es de importación,
emitido por la autoridad sanitaria u organismo competente del país de origen.
3.3.9.2 Copia de
la carta de representación del proveedor.
3.4 SOLICITUD DE MODIFICACIONES A LAS
CONDICIONES DE REGISTRO SANITARIO DE MEDICAMENTOS:
3.4.1 Para todas las modificaciones:
3.4.1.1 Proyectos
de etiqueta conforme a la norma correspondiente.
3.4.1.2 En su
caso, proyectos de texto de las versiones amplia y reducida de la información
para prescribir.
3.4.2 Además de los documentos anteriores,
deberán incluirse los siguientes:
3.4.2.1 Para modificaciones de nombre y/o
domicilio del titular del registro o del maquilador
nacional sin cambio en el proceso de producción:
3.4.2.1.1 Copia de
los últimos marbetes autorizados
3.4.2.2 Por modificación del nombre comercia
del medicamento:
3.4.2.2.1 Copia de
los últimos marbetes autorizados.
3.4.2.3 Para modificación de envase secundario
3.4.2.3.1 Copia de
los últimos marbetes autorizados.
3.4.2.4 Para modificaciones a los textos de la
información para prescribir, en sus versiones amplia y reducida:
3.4.2.4.1 Copia de
la última versión de la información para prescribir en sus versiones amplia y
reducida autorizada.
3.4.2.4.2
Información bibliográfica que fundamente la modificación propuesta.
3.4.2.5 Para modificación a las condiciones de
venta y suministro al público:
3.4.2.5.1 Copia de
los últimos marbetes autorizados.
3.4.2.5.2
Justificación bibliográfica que avale el cambio solicitado.
3.4.2.5.3 En su
caso, certificado de libre venta del país de origen emitido por la autoridad
sanitaria competente.
3.4.2.6 Por modificación a la presentación y
contenido de los envases, incluyendo los del Cuadro Básico de Medicamentos:
3.4.2.6.1 Copia de
los últimos marbetes autorizados
3.4.2.6.2
Justificación farmacológica del o los esquemas terapéuticos con el apoyo
bibliográfico correspondiente.
3.4.2.7 Por revocación del registro a petición
de parte:
3.4.2.7.1 No se
requieren documentos anexos.
3.4.2.8 Para cambio de aditivos o excipientes
sin cambio en la forma farmacéutica o principios activos:
3.4.2.8.1 Pruebas
de estabilidad de acuerdo con la Norma Oficial Mexicana correspondiente.
3.4.2.8.2
Monografía de los aditivos y excipientes y sus referencias bibliográficas para
cambios de dichos ingredientes.
3.4.2.8.3 Método
de control y especificaciones de los fármacos y aditivos y producto terminado y
su validación, firmado por el responsable sanitario del establecimiento.
3.4.2.8.4
Certificado de análisis.
3.4.2.8.5
Justificación técnica que avale el cambio solicitado.
3.4.2.9 Para cambios de envase primario:
3.4.2.9.1 Pruebas
de estabilidad de acuerdo con la Norma Oficial Mexicana correspondiente.
3.4.2.9.2 Método
de control y especificaciones de los fármacos y aditivos y producto terminado y
su validación, firmado por el responsable sanitario del establecimiento.
3.4.2.9.3
Justificación técnica por escrito que avale la necesidad o conveniencia de
cambiar el envase primario.
3.4.2.10 Para modificación al plazo de
caducidad:
3.4.2.10.1 Pruebas
de estabilidad de acuerdo con la Norma Oficial Mexicana correspondiente.
3.4.2.10.2 Método
de control y especificaciones de los fármacos y aditivos y producto terminado y
su validación.
3.4.2.10.3
Original del Certificado de análisis.
3.4.2.10.4
Justificación técnica que avale el cambio solicitado.
3.4.2.11 Por cambio de fabricación nacional a
extranjera:
3.4.2.11.1 Copia
de los últimos marbetes autorizados.
3.4.2.11.2 Pruebas
de estabilidad de acuerdo con la Norma Oficial Mexicana correspondiente.
3.4.2.11.3 Método
de control y especificaciones de los fármacos y aditivos y producto terminado y
su validación, firmados por el responsable sanitario del establecimiento
3.4.2.11.4
Original del certificado de libre venta expedido por la autoridad competente
del país de origen.
3.4.2.11.5
Original del certificado de análisis emitido por el fabricante del medicamento
en papel membretado y avalado por los responsables
sanitarios de las empresas extranjera y nacional.
3.4.2.11.6 Carta
de representación del fabricante autenticada por el procedimiento legal que
exista en el País de origen, en español o en otro idioma, con su respectiva
traducción al español por perito traductor, cuando el laboratorio no sea filial
o casa matriz del laboratorio que solicita la modificación del registro sanitario.
3.4.2.12 Para cambio de fabricación extranjera
a nacional de medicamentos alopáticos:
3.4.2.12.1
Información técnica y científica que demuestre:
3.4.2.12.1.1 La
identidad y pureza de sus componentes de acuerdo con lo que establece la
Farmacopea de los Estados Unidos Mexicanos y sus suplementos.
3.4.2.12.1.2 La
estabilidad del producto terminado conforme a la Norma Oficial Mexicana
correspondiente.
3.4.2.12.1.3 La
eficacia terapéutica y seguridad de acuerdo con la información científica que
corresponda.
3.4.2.13 Para cambio de fabricación extranjera
a nacional de medicamentos homeopáticos:
3.4.2.13.1 La
información técnica y científica que demuestre:
3.4.2.13.2 La
identidad y pureza de sus componentes de acuerdo con lo que establezca la
Farmacopea Homeopática de los Estados Unidos Mexicanos y sus suplementos o, en
su defecto, las Farmacopeas Homeopáticas de otros países o fuentes de
información científica internacional.
3.4.2.13.3 La
estabilidad del producto terminado conforme a la Norma Oficial Mexicana
correspondiente.
3.4.2.13.4
Indicaciones terapéuticas.
3.4.2.13.5
Patogénesis de principios activos.
3.4.2.13.6
Instructivo para su uso.
3.4.2.13.7
Descripción del proceso de fabricación del medicamento.
3.4.2.14 Para cambio de fabricación extranjera
a nacional de medicamentos herbolarios:
3.4.2.14.1 La
información técnica y científica que demuestre:
3.4.2.14.1.1 La
identidad y pureza de sus componentes de acuerdo con lo que establezca las
Farmacopeas Especiales o, en su defecto, las fuentes de información científica
internacional.
3.4.2.14.1.2 La
estabilidad del producto terminado.
3.4.2.14.1.3 La
identificación taxonómica.
3.4.2.14.2
Indicaciones terapéuticas.
3.4.2.14.3
Instructivo para su uso.
3.4.2.14.4
Descripción del proceso de fabricación del medicamento.
3.4.2.15 Para cambios en los procesos de
fabricación:
3.4.2.15.1 Copia
de los últimos marbetes autorizados.
3.4.2.15.2 Copia
del aviso que avale el cambio de nombre y/o domicilio del titular del registro
por cesión de derechos.
3.4.2.15.3 Pruebas
de estabilidad de acuerdo con la Norma Oficial Mexicana correspondiente.
3.4.2.15.4
Monografía de los fármacos y aditivos y sus referencias bibliográficas.
3.4.2.15.5 Método
de control y especificaciones de los fármacos y aditivos y producto terminado y
su validación, firmado por el responsable sanitario del establecimiento.
3.4.2.15.6 Copia
del certificado de análisis.
3.4.2.15.7 Copia
del aviso de maquila de medicamentos.
3.4.2.16 Para cambio de la identificación
terapéutica:
3.4.2.16.1
Información científica o resultados finales de la investigación que demuestren
la seguridad y eficacia terapéutica.
3.4.2.17 Para modificación a medicamentos
genéricos intercambiables:
3.4.2.17.1
Presentar las pruebas técnicas correspondientes publicadas el 10 de marzo de
1998 en el D.O.F. por el Consejo de Salubridad
General y la SSA.
3.4.2.18 Por cesión de derechos:
3.4.2.18.1 Copia
de la escritura pública donde conste la cesión.
3.4.2.18.2 Copia
del registro sanitario de cada uno de los productos.
3.4.2.18.3 Copia de
los proyectos de marbete autorizados de cada uno de los productos.
3.4.2.18.4 Copia
de las licencias sanitarias del cesionario y cedente.
4. PARA LOS CASOS DE CERTIFICADOS DE
EXPORTACION:
4.1 CERTIFICADO DE BUENAS PRACTICAS DE
FABRICACION:
4.1.1 Aviso de
funcionamiento o Licencia Sanitaria.
4.2 CERTIFICADO DE EXPORTACION DE INSUMOS PARA
LA SALUD.
4.2.1
Número de registro sanitario, en su caso
4.2.2
Carta de aceptación del importador final en papel membretado.
4.3 CERTIFICADO DE LIBRE VENTA DE INSUMOS PARA
LA SALUD.
4.3.1 Copia del
registro sanitario y de la modificación correspondiente, en su caso, así como
de sus anexos.
4.3.2 Fórmula, en
su caso.
4.3.3 Ultima orden
de producción.
4.4 CERTIFICADO PARA EXPORTACION DE LIBRE
VENTA DE ALIMENTOS, BEBIDAS ALCOHOLICAS, NO ALCOHOLICAS, ETC.
4.4.1 Etiquetas
del producto a exportar cuando se presente la solicitud por primera vez, cuando
ha transcurrido un año desde la última presentación, o cuando existan
modificaciones a ésta. Si por las características del producto no es posible
presentarla, se podrá presentar envase secundario que contenga las etiquetas,
siempre y cuando éste no sea voluminoso, en cuyo caso se tendrá la opción de
entregar fotografías, de 20 por 25 centímetros, del envase por todas sus caras.
4.5 CERTIFICADO PARA EXPORTACION ANALISIS DE
ALIMENTOS, BEBIDAS ALCOHOLICAS, NO ALCOHOLICAS, ETC.
4.5.1 Resultados
originales de laboratorio efectuados a los productos que se van a exportar.
4.6 CERTIFICADO PARA EXPORTACION DE LIBRE
VENTA, DE ANALISIS DE PRODUCTO Y DE CONFORMIDAD DE BUENAS PRACTICAS SANITARIAS.
4.6.1 En la modalidad de libre venta:
4.6.1.1 Etiqueta
original con la que se comercializa el producto.
4.6.2 En la modalidad de análisis del
producto:
4.6.2.1 Resultados
de análisis efectuados por un laboratorio aprobado por la Secretaría de Salud
(copia y original).
4.6.3 En la modalidad de conformidad con las
buenas prácticas sanitarias:
4.6.3.1 No se
requieren documentos anexos.
4.6.4 En la modalidad de modificación de
certificación de exportación:
4.6.4.1 Original
del Certificado de exportación vigente.
4.7 CERTIFICADO DE CUMPLIMIENTO CON LAS NORMAS
OFICIALES MEXICANAS.
Normas: NOM-010-SSA1-1993 Y NOM- 015/1-SCFI-SSA-1994.
4.7.1 Resultado(s)
del (los) análisis de la(s) muestra(s) de (los) producto(s) que se pretende(n)
certificar, previo a la importación realizados por laboratorios aprobados por
la SSA (original).
4.8 DICTAMEN SANITARIO DE EFECTIVIDAD
BACTERIOLOGICA DE EQUIPOS O SUSTANCIAS GERMICIDAS PARA POTABILIZACION DE AGUA.
TIPO DOMESTICO.
4.8.1 Comprobante
del pago de derechos por la fracción 195-k-3.
4.8.2 Paquete de
información técnica del producto conteniendo: instructivo de uso u operación,
hoja de seguridad del producto formulado o de las sustancias que formen parte
del equipo, así como las características de dicho equipo.
4.8.3 Informe de
pruebas de eficiencia bactericida o germicida del producto, realizadas en el
Laboratorio Nacional de Salud Pública, en laboratorios acreditados o por
terceros autorizados.
4.8.4 Etiqueta
comercial del producto.
5. PARA LOS CASOS DE SOLICITUD DE VISITA
SANITARIA.
5.1 Visita sanitaria de Verificación.
5.1.1 No se
requieren documentos anexos.
6. PARA LOS CASOS DE
SOLICITUD DE AUTORIZACION:
6.1 SOLICITUD DE
AUTORIZACION de Terceros.
6.1.1 documentos
que demuestren la capacidad técnica, material, humana y financiera, así como
las instalaciones, equipo y tecnología para llevar a cabo las pruebas,
estudios, verificaciones y demás actividades necesarias para emitir los
dictámenes (original).
6.1.2
Procedimientos que muestren que el solicitante cuenta con procedimientos
normalizados de operaciones que garanticen la calidad en el desempeño de sus
funciones (original).
6.1.3 Propuestas
de actividades a dictaminar (original).
6.1.4 Descripción
de los servicios que pretende prestar y los procedimientos a utilizar
(original).
6.2 SOLICITUD DE AUTORIZACION DE PROTOCOLOS DE
INVESTIGACION DE MEDICAMENTOS.
6.2.1 Para todos los casos:
6.2.1.1 Protocolo
de investigación que deberá contener un análisis objetivo y completo de los
riesgos involucrados comparados con los riesgos de los métodos de diagnóstico y
tratamiento establecidos y la expectativa de las condiciones de vida del sujeto
con y sin el procedimiento o tratamiento propuesto.
6.2.1.2 Carta de
aceptación del titular de la institución donde se efectuará la investigación.
6.2.1.3 Dictamen
favorable de las comisiones de investigación, ética y, en su caso, de bioseguridad.
6.2.1.4
Descripción de los recursos disponibles, incluyendo áreas, equipo y servicios
auxiliares de laboratorio y gabinetes.
6.2.1.5
Descripción de los recursos disponibles para el manejo de urgencias médicas.
6.2.1.6 Historial
profesional del investigador principal, que incluya su preparación académica,
producción científica representativa y práctica clínica o experiencia en el
área de investigación propuesta.
6.2.1.7
Preparación académica y experiencia del personal médico, paramédico y otros
expertos que participarán en las actividades de la investigación.
6.2.1.8 Carta de
consentimiento informado del paciente.
6.2.1.9 Carta de
confidencialidad de los investigadores.
6.2.1.10
Cronograma del estudio.
6.2.2 Además de los documentos anteriores
deberán incluirse los siguientes:
6.2.2.1 Para el empleo en seres humanos de
medicamentos de investigación durante su valoración a través de las fases I a
IV de investigación farmacológica clínica:
6.2.2.1.1 La información farmacológica básica y
preclínica del medicamento.
6.2.2.1.2 La información
previamente obtenida sobre farmacología clínica, en caso de las fases II, III y
IV y pruebas de biodisponibilidad cuando se
requieran.
6.2.1.1 Para la investigación de otros nuevos
recursos:
6.2.1.1.1 Los fundamentos científicos, información sobre
la experimentación previa realizada en animales, en laboratorio.
6.2.1.1.2 Estudios previos de investigación clínica,
cuando los hubiere.
6.2.2 Los demás que señalen las Normas
Oficiales Mexicanas que al efecto emita la Secretaría de Salud.
6.3 SOLICITUD DE AUTORIZACION DE CLAVE
ALFANUMERICA DE REMEDIOS HERBOLARIOS.
6.3.1 Certificado de análisis de producto terminado
de aspectos organolépticos, físicos y microbiológicos y ausencia de residuos
tóxicos.
6.3.2 Descripción del proceso de fabricación.
6.3.3 Certificado de autenticación taxonómica por
cada componente o el documento en el que conste la información sobre la
identidad de los componentes.
6.3.4 Denominación científica y popular de la(s)
planta(s) empleadas.
6.3.5 Indicaciones y tiempo para su uso.
6.3.6 Proyectos de marbete o etiqueta.
6.3.7 Fórmula cuali-cuantitativa
de los componentes y aditivos (deberá ir firmada por el responsable sanitario).
6.3.8 En caso de que el producto sea de
fabricación extranjera, además de lo anterior se deberá incluir:
6.3.8.1 Original (para cotejo) y copia del certificado
de libre venta expedido por la autoridad sanitaria del país de origen.
6.3.8.2 Original (para cotejo) y copia del certificado
de análisis emitido por la empresa que fabrica el remedio herbolario, con el
membrete de su razón social y avalado por los químicos responsables de la
empresa extranjera y nacional.
6.3.8.3 Original (para cotejo) y copia del Certificado
de buenas prácticas de fabricación.
6.3.8.4 Carta de representación (Si el producto es
fabricado por la casa matriz o filial del laboratorio solicitante en México, no
se requerirá de la carta de representación).
6.3.8.5 Proyectos de etiqueta en español y de
contra-etiqueta, en su caso.